-
下列元素在自然界既可以游离态存在,又可以化合态存在的是
A. 氯 B. 钠 C. 氮 D. 硅
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化
B. 实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞
C. 玛瑙、光导纤维、钻石的主要成分均为SiO2
D. 钠、镁等活泼金属着火时,可用干粉灭火器灭火
难度: 简单查看答案及解析
-
下列叙述正确的是
A. SiO2、NO、SO2、SO3属于非金属氧化物,又属于酸性氧化物
B. NH3形成铵盐的过程属于氮的固定
C. 纯铁的熔点比生铁低
D. 可以用光洁无锈的铁丝代替铂丝作焰色反应实验
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使石蕊试液变红的溶液中:Fe2+、SO42-、NO3-
B. 能与Al片作用产生H2的溶液: Cl-、NO3-、Na+
C. 某碱性溶液: Cl-、Na+、HCO3-
D. 澄清透明的溶液: Cu2+、Mg2+、SO42-
难度: 简单查看答案及解析
-
下列各组物质中,不满足右图物质一步转化关系的选项是
选项
X
Y
Z
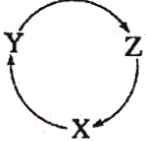
A
HCl
Cl2
HClO
B
Fe
FeCl2
FeCl3
C
S
H2S
SO2
D
NO
N2
NH3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 已知氧化性Fe3+>I2,则FeCl2 溶液中滴加碘水: 2Fe2++I2=2Fe3++2I-
B. 向碳酸氢铵溶液中滴加过量热的氢氧化钠溶液NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O
C. 向盐酸中滴加氨水: H++OH-= H2O
D. 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
难度: 中等查看答案及解析
-
下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是
①金属钠投入MgCl2溶液中
②过量的NaOH溶液和明矾溶液
③碳酸氢铵加到过量的热的Ba(OH)2 溶液中
④过量的Na2O2投入FeCl2溶液中
⑤过量NaOH和Ca(HCO3)2溶液混合
A. ①④ B. ②③ C. ①③④ D. ③④⑤
难度: 中等查看答案及解析
-
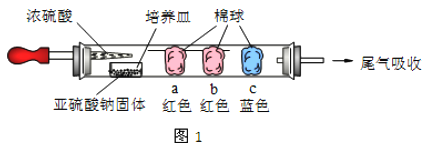
常温下,下列实验中能证明有SO2气体存在的是
①使澄清石灰水变浑浊 ②使湿润的蓝色石蕊试纸变红 ③使品红褪色④通入足量NaOH溶液中,再滴加BaCl2 溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入溴水中能使溴水褪色,且滴加BaCl2溶液有白色沉淀产生⑥ 通入Ba(NO3)2溶液中有白色沉淀产生,该沉淀不溶于稀盐酸
A. 都能证明 B. 只有⑤⑥能证明 C. ③④⑤能证明 D. 都不能证明
难度: 中等查看答案及解析
-
在允许加热的条件下,只用一种试剂可以鉴别的组合是
① (NH4)2SO4、KCl、MgCl2、Al2(SO4)3、FeSO4六种溶液
②Na2S、NaHSO3、NaAlO2、Na2SiO3、Na2SO4六种溶液
③FeO、CuO、MnO2、C四种黑色固体
④NaCl、Na2CO3、NaHSO4三种溶液
⑤Na2SO4、KSCN、KOH、AgNO3四种溶液
A. 只有①③⑤ B. 除④ C. 除①③④ D. 全部
难度: 困难查看答案及解析
-
某课外实验小组设计的下列实验合理的是
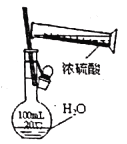

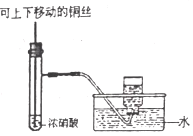
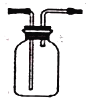
A.配制100mL一定物质的量浓度的硫酸溶液
B.用CO2做喷泉实验
C.制备并收集少量NO2气体
D.装置可用于收集NH3、NO、Cl2等气体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
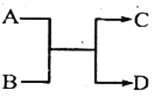
A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒(分子或离子),且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
难度: 中等查看答案及解析
-
ag Mg、Al合金完全溶解在C1mol/L、V1LHCl溶液中,产生bmolH2。再向反应后的溶液中加入C2mol/L V2L NaOH 溶液,恰好使沉淀达到最大值,且沉淀质量为dg。下列关系不正确的是
A. d=a+34b B.
C. 铝的质量为
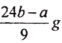 D. 与金属反应后剩余盐酸为(C1V1-2b)mol
D. 与金属反应后剩余盐酸为(C1V1-2b)mol难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数,则下列说法正确的是
A. 标准状况下,80gSO3所含的体积约为22.4L
B. 1molFe 分别与足量的Cl2及盐酸反应时,失去的电子数均为3NA
C. 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D. 铜与硫的反应中,1mol铜失去的电子数为2NA
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN 溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将少量新制氯水滴加到蓝色石蕊试纸上
试纸先变红后褪色
氯气有漂白性
C
取少许可能部分变质的亚硫酸钠固体溶于水制成溶液,向其中先加入BaCl2 溶液,后加入稀硝酸
产生白色沉淀
证明亚硫酸钠已变质
D
将浓硫酸滴在木条上
木条变黑
浓硫酸有脱水性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应过程,不能实现的是
A. Cu 放入稀H2SO4 中无明显现象,向其中加入KNO3,则Cu溶解并有气体产生
B. CO2通入Ca(ClO)2 溶液中得到次氯酸,证明次氯酸是弱酸。
C. NO2通入FeCl2 溶液中得到黄色溶液
D. 除去CO2 中HCl气体,可以将混合气体通入盛有饱和Na2CO3溶液的洗气瓶中
难度: 中等查看答案及解析
-
下到关于物质或离子检验的叙述正确的是
A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 灼烧白色粉未中火焰成黄色,证明原粉末中有Na+,无K+
C. 某溶液中加入盐酸无明显现象,再加入BaCl2溶液产生白色沉淀,证明原溶液中一定含有SO42-
D. 某无色混合气体通过足量的过氧化钠固体,则有红棕色气体产生,则原混合气体中一定有NO 和CO2
难度: 中等查看答案及解析