-
下列有关物质的分类或归类不正确的是
A.混合物:漂白粉、福尔马林、水玻璃
B.化合物:CaCl2、烧碱、HD
C.电解质:明矾、HCl、硫酸钡
D.纯净物:干冰、冰水混合物、红宝石
难度: 中等查看答案及解析
-
用1L 1.0mol•L﹣1 NaOH溶液吸收0.8mol CO2,所得溶液中的CO32﹣和HCO3﹣的浓度之比约是
A.1:3 B.1:2 C.2:3 D.3:2
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.6.4g由O3和O2组成的混合气体中一定含有0.4NA个原子
B.常温常压下,5.6g铁粉在7.1g氯气中充分燃烧,失去的电子数目为0.3NA
C.常温下,pH=1的HNO3溶液中含有0.1NA个H+
D.0.1mol KHSO4晶体中含有的阳离子数是0.2NA
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=8的溶液:K+、Fe3+、NO3﹣、Cl﹣
B.能与Al反应产生H2的溶液:K+、Na+、SO42﹣、Cl﹣
C.含FeCl3的溶液:K+、NH4+、I﹣、SCN﹣
D.c(OH﹣)=1×10﹣13 mol•L﹣1的溶液:NH4+、Na+、Si32﹣、CH3COO﹣
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.H2O2溶液与酸性KMnO4溶液反应:2MnO3﹣+3H2O2+6H+═2Mn2++6H2O+4O2↑
B.向Fe(NO3)3溶液中加入过量的HI溶液:2NO2﹣+8H++6I﹣═3I2+2NO↑+4H2O
C.少量SO2通入碳酸钠溶液中:CO32﹣+SO2═CO2+SO32﹣
D.0.01 mol•L﹣1 NH4Al(SO4)2溶液与0.02 mol•L﹣1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO32﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3•H2O
难度: 困难查看答案及解析
-
对于反应A2(g)+2B2 (g)⇌2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
A.
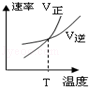 B.
B.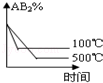 C.
C.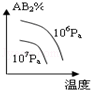 D.
D.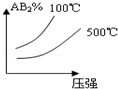
难度: 困难查看答案及解析
-
已知:5S2O82﹣+2Mn2++8H2O═2MnO4﹣+10SO42﹣+16X,对于该反应下列叙述不正确的是
A.氧化剂和还原剂的物质的量之比为5:2
B.该反应体系不能用盐酸酸化
C.若有0.1 mol还原剂被氧化,则转移电子0.5 mol
D.若把该反应设计为原电池,则正极反应为S2O82﹣﹣2e﹣═2SO42﹣
难度: 困难查看答案及解析