-
铁是目前人类使用量最大的金属,它能形成多种化合物.
(l)工业上,向炽热铁屑中通入氯化氢可生成无水氯化亚铁,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3,常用的试剂是 ;为防止FeC12溶液中含有FeCl3,最好在FeCl2溶液中加入
(2)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
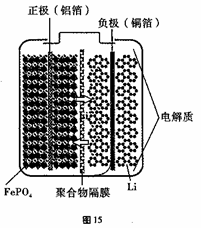
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,同时伴随产生一种可燃性气体,该反应的化学方程式为 。若有1mol C参与反应,则转移的电子数目为
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开,只允许锂离子通过)工作原理为FePO4+Li LiFePO4。如图所示,则放电时FePO4一端为电池的 极,充电时阳极上的电极反应式为______________________________。
LiFePO4。如图所示,则放电时FePO4一端为电池的 极,充电时阳极上的电极反应式为______________________________。
(3)硫化亚铁常用于工业废水的处理。已知25℃时,溶度积常数Ksp[FeS]=6.3×10-18, 3.6×10-29。请写出用硫化亚铁处理含Cd2十的工业废水的离子方程式:
3.6×10-29。请写出用硫化亚铁处理含Cd2十的工业废水的离子方程式:
在FeS、CdS的悬浊液中 =
=
(4)已知25℃时,尺,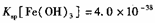 ,此温度下若在实验室中配制
,此温度下若在实验室中配制 溶液,为使配制过程中不出现浑蚀现象,则至少需要加入 mL 2lnol/L的盐酸〔体积变化忽略不计)
溶液,为使配制过程中不出现浑蚀现象,则至少需要加入 mL 2lnol/L的盐酸〔体积变化忽略不计)
-
硫及其化合物有广泛应用。
(l)硫酸生产过程中涉及以下反应。已知25℃、10lkPa时:
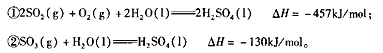
则SO2催化氧化为SO3(g)的热化学方程式为
(2)对于SO2催化氧化为SO3的反应。
①图甲是SO2(g)和SO3(g)的浓度随时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为
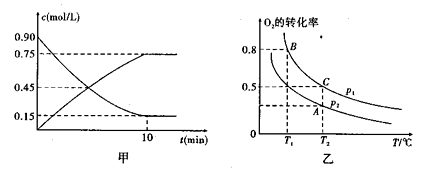
②在一容积可变的密闭容器中充入20mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(p)的变化如图乙所示。则p1与p2的大小关系是p1 p2:(填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 (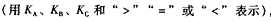 ),理由是
),理由是
(3)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为
所得溶液中 = (填序号)。
= (填序号)。
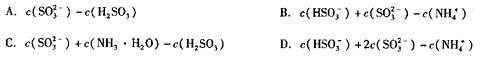
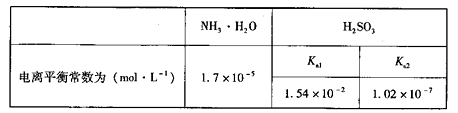
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为
-
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166 /mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)①高铁酸钠主要通过如下反应制取: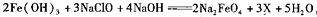 ,则X的化学式为
,则X的化学式为
②NNa2FeO4之所以能净水,除它本身具有强氧化性外,另一个原因可能是
(2)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请回答:
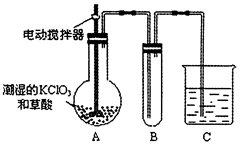
①A中反应产物有 和CO2等,该反应氧化剂与还原剂物质的量之比为
和CO2等,该反应氧化剂与还原剂物质的量之比为
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计,B部分还应补充的装置为___________,理由是
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是 (填“A’’“B”或“C,’),请在图方框中画出该装置改正后的正确的装置图

④ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试徉的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知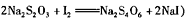
当 时,可以判断此滴定操作到达终点;由以上数据可以计算原ClO2溶液的浓度为 g/I(用含字母的代数式表示)。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么 三种消毒杀菌剂的消毒效率最小的是 (填化学式)。
三种消毒杀菌剂的消毒效率最小的是 (填化学式)。
-
【化学—选修2:化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(l)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技又分为 。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为
(2)煤在燃烧前后及燃烧过程中均可采取措施减少有害气体的排放
①在燃烧前,可以采用微生物脱硫技术。原理如图所示:
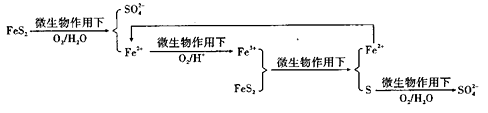
图示过程中Fe2+的作用为 写出 的离子方程式:
的离子方程式:
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,再把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入
设备,用石灰水淋洗。
-
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO简写为Ac)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
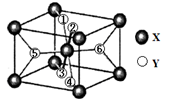
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为 ,XY2的摩尔质量为
,XY2的摩尔质量为 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
-
【化学——有机化学基础】有机物N和R为高分子材料,其制取的流程如图所示:
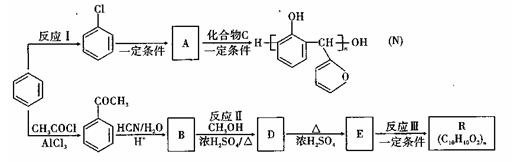
已知: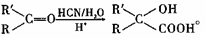
(1)反应I的反应条件是 ;化合物C的结构简式是
(2)由 的反应类型是 ,D生成E的过程中,浓硫酸的作用是
的反应类型是 ,D生成E的过程中,浓硫酸的作用是
(3)B中的含氧官能团为
(4)反应II的化学方程式为 。
(5)下列说法正确的是 (填序号)。
a、常温下,A能和水以任意比混溶
b、A可与NaOH溶液反应
c、化合物C可使高锰酸钾酸性溶液褪色
d、E存在顺反异构休
(6)反应III的化学方程式为
(7)符合下列条件的B的同分异构体有 种。
a.能与饱和溴水反应生成白色沉淀;
b.属于酯类;
c.苯环上只有两个取代基
Cl
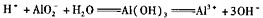
的溶液中:
的溶液中:
的溶液中:
CH和
互为同系物
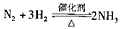 ,达到平衡时,
,达到平衡时,变小

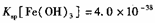 ,此温度下若在实验室中配制
,此温度下若在实验室中配制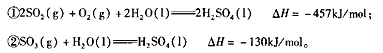

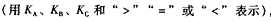 ),理由是
),理由是

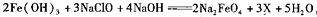 ,则X的化学式为
,则X的化学式为
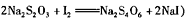



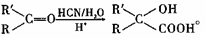
 的反应类型是
的反应类型是