-
下列物质中属于强电解质的是
A.NH3·H2O B.Cl2 C.NaCl溶液 D.NaHCO3
难度: 简单查看答案及解析
-
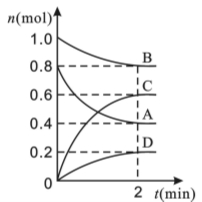
在不同条件下分别测N2(g)+3H2(g)
2NH3(g)的反应速率,其中表示该反应速率最快的是
A.v (N2)=3 mol·L-1·min-1 B.v (NH3)=2 mol·L-1·s-1
C.v (H2)= 2.5mol·L-1·s-1 D.v (NH3)=10mol·L-1·min-1
难度: 中等查看答案及解析
-
在空气中,如图所示的四种情况里,可以加快铁的腐蚀的是
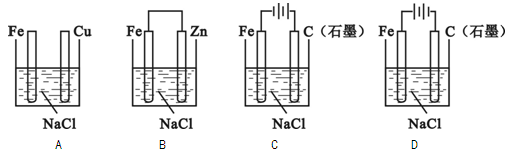
难度: 简单查看答案及解析
-
下列各组离子能大量共存于同一溶液中的是
A.Ba2+、Mg2+、Cl-、CO32-
B.Fe3+、K+、I-、SO42-
C.K+、NH4+、NO3—、OH—
D.Al3+、NH4+、NO3—、Cl—
难度: 中等查看答案及解析
-
下列说法错误的是
A.化学反应必然伴随能量的变化
B.放热反应不一定是自发进行
C.化学反应一定有化学键的断裂与形成
D.需要加热才能发生的反应一定是吸热反应
难度: 简单查看答案及解析
-
现将足量的AgCl固体分别放入下列物质中,所得溶液中c(Ag+)最小是
A.10 mL 0.2mol·L-1MgCl2溶液 B.20 mL 0.5 mol·L-1 AgNO3溶液
C.40 mL 0.3mol·L-1 HCl溶液 D.15 mL 0.1mol·L-1 AlCl3溶液
难度: 中等查看答案及解析
-
用石墨电极,电解一定浓度的下列四种物质的水溶液。电解一段时间后,若只往所得溶液中适量的水,可以恢复到电解前的状态。该物质是
A.AgNO3 B.NaCl C.KOH D.CuCl2
难度: 中等查看答案及解析
-
下列水溶液的浓度均为0.1mol.L-1,其中溶液pH最小的是
A.Na2CO3溶液 B.NaOH溶液 C.NaHSO4溶液 D.NH4Cl溶液
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.c (H+) × c(OH-) =10-14的溶液
B.n(H+)=n(OH—) 的溶液
C.c (H+)=1.0×10-7 mol/L的溶液
D.pH=3的酸与pH=11的碱等体积混合后的溶液
难度: 中等查看答案及解析
-
25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是
A.2H2O(l) ===2H2(g)+O2(g); ΔH =+571.6 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g); ΔH =-571.6 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l); ΔH =+571.6 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l); ΔH =-285.8kJ·mol-1
难度: 中等查看答案及解析
-
下列化学反应表示正确的是
A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO-
B.用惰性电极电解饱和NaCl溶液: 2H++2Cl-
Cl2↑+H2↑
C.用石墨作电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D.钢铁发生吸氧腐蚀时负极反应为:Fe - 3e- = Fe3+
难度: 中等查看答案及解析
-
室温下,对于CH3COONa的说法下列判断正确的是
A.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.升高温度,c(OH—)与c(CH3COO—)的比值将减小
C.CH3COONa稀溶液加水稀释时,溶液中各离子浓度均减小
D.c(CH3COO-)+ c(CH3COOH)=c(Na+)
难度: 中等查看答案及解析
-
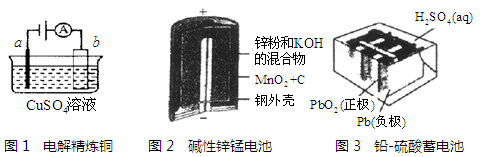
用如图装置进行实验(A为电流计),观察到现象:Cu电极上产生大量的无色气泡。下列说法正确的是
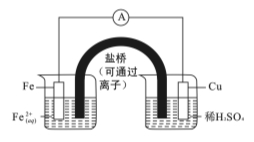
A.电子由Cu电极流向Fe电极
B.盐桥中的阳离子移向左池
C.Fe电极为负极,Cu电极为正极
D.Cu电极的电极反应式为:Cu-2e- =Cu2+
难度: 中等查看答案及解析
-
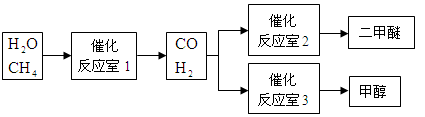
某一容器中发生如下反应:2NO(g)+O2(g)
2NO2(g); ΔH = Q kJ·mol-1
在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的关系如图所示。下列判断正确的是
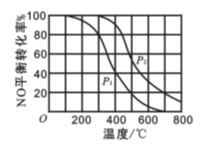
A.p2 > p1 且Q <0
B.p2 > p1 且Q >0
C.p2 < p1 且Q <0
D.p2 < p1 且Q >0
难度: 中等查看答案及解析
-
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸化学式
HF
CH3COOH
HClO
H2CO3
电离常数
6.8×10-4
1.7×10-5
4.7×10-8
K1=4.3×10-7
K2=5.6×10-11
下列推断正确的是
A.弱酸的酸性强弱:HF < HClO
B.同物质的量浓度NaClO与NaHCO3溶液,前者的pH较大
C.将碳酸钠粉末加入到0.1mol·L_1 HClO溶液中,不发生反应
D.中和等体积、等pH的HF和CH3COOH溶液,消耗等量的NaOH
难度: 困难查看答案及解析