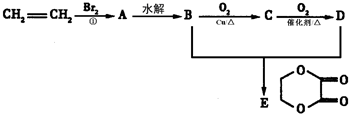
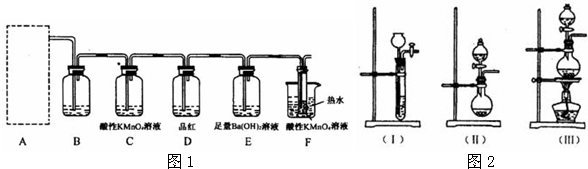
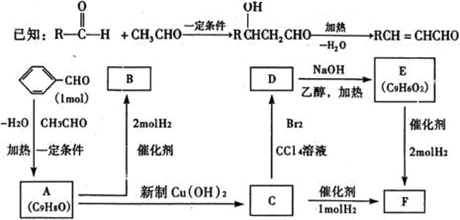
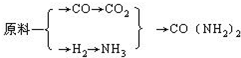
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W难度: 中等查看答案及解析
-
将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是( )
A.CO2
B.NH3
C.NO2
D.H2S难度: 中等查看答案及解析
-
下列有关化学用语正确的是( )
A.氮气分子的电子式:
B.次氯酸的结构式:H-Cl-O
C.氯离子的结构示意图: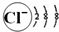
D.葡萄糖的最简式:CH2O难度: 中等查看答案及解析
-
为了检验某FeCl2溶液是否变质,可向溶液中加入( )
A.NaOH溶液
B.铁片
C.KSCN溶液
D.石蕊溶液难度: 中等查看答案及解析
-
常温下,某水溶液中由水电离的c(H+)=1.8×10-12mol/L,该溶液一定不可能是( )
A.烧碱溶液
B.碳酸氢钠溶液
C.硝酸溶液
D.硫酸氢钠溶液难度: 中等查看答案及解析
-
“三鹿奶粉事件”中添加的三聚氰胺的结构如图所示,关于该化合物的说法正确的是( )
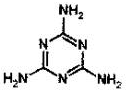
A.三聚氰胺含有苯环结构
B.三聚氰胺是苯的同系物
C.分子式为N6H6
D.含氮的质量分数为66.67%难度: 中等查看答案及解析
-
有关能量的判断或表示方法正确的是( )
A.由:H+(aq)+OH -(aq)=H2O(l)△H=-57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ
B.从C(石墨)→C(金刚石)△H=+119kJ/mol,可知:金刚石比石墨更稳定
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2+O2=2 H2O△H=-285.8kJ/mol难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数,下列叙述错误的( )
A.46g二氧化氮与四氧化二氮的混合气体中的原子数大于3NA
B.28g乙烯、丙烯、丙烷的混合气体中的碳原子数小于2NA
C.1mol/L 500mL氯化镁溶液中的镁离子数小于0.5NA
D.标态下,11.2L三氧化硫中所含的氧原子数大于1.5NA难度: 中等查看答案及解析
-
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)⇌hH(g)达到平衡后,A、B、H的物质的量分别为amol、bmol和hmol.已知a+b=h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是( )
A.气体的平均相对分子质量变大
B.平衡不移动
C.B的体积分数减少
D.混合气体的密度不变难度: 中等查看答案及解析
-
下列离子方程式错误的是( )
A.硫化钠溶液中加入少量盐酸:S2-+H+=HS-
B.用硫酸铜溶液吸收硫化氢气体:Cu2++H2S=CuS↓+2H+
C.向氨水中开始滴入硫酸铝溶液:A13++3NH3•H2O=A1(OH)3↓+3NH4+
D.向碳酸氢钙溶液中开始滴入氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-难度: 中等查看答案及解析
-
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是( )
A.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CH3COO-)
B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.PH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)难度: 中等查看答案及解析
-
下列相关实验不能表达预期目的是( )
相关实验 预期目的 A 把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢 验证接触面积对化学反应速率的影响 B 把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化 验证温度对化学平衡的影响 C 在蔗糖中加入适量的硫酸溶液,加热,充分水解后加入新制的氢氧化铜悬浊液并加热,观察沉淀的颜色 验证蔗糖水解产物中有醛基的存在 D 在装有同样浑浊的苯酚溶液的两个试管中,对其中一支试管加热,观察溶液是否变澄清 比较苯酚在不同温度下的溶解度
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
以惰性电极电解CuSO4溶液.一段时间后取出电极,加入9.8g Cu(OH)2后溶液与电解前相同,则电解时电路中流过的电子为( )
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol难度: 中等查看答案及解析
-
下列有关除杂质(括号中为杂质)的操作中,错误的是( )
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.甘油(水):用分液漏斗分离
C.苯(苯酚):加NaOH溶液,充分振荡,分液,弃水层
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层难度: 中等查看答案及解析
-
下列说法错误的是( )
A.用大米酿的酒在一定条件下密封保存,时间越长越香醇
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应难度: 中等查看答案及解析
-
酚酞的结构如右图,则下列说法中正确的是( )
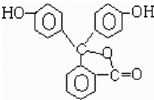
A.酚酞是芳香烃
B.酚酞分子式是C26H12O4
C.酚酞能与溴水反应,产生白色沉淀
D.每1mol 酚酞最多能与2mol NaOH反应难度: 中等查看答案及解析
-
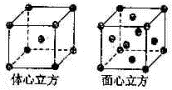
某原子核外共有6个电子,分布在K与L电子层上,其基态原子在L层分布中正确的是( )
A.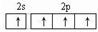
B.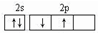
C.
D.
难度: 中等查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形难度: 中等查看答案及解析
-
下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利
C.由于2SO2(g)+O2(g)⇌2SO3(g),所以硫酸生产中常采用高压条件提高SO2的转化率
D.充分利用硫酸厂生产过程中产生的“废热”,可使硫酸厂向外界输出大量的能量难度: 中等查看答案及解析
-
下列物质的制备不符合工业生产实际的是( )
A.在洗涤剂烷基苯磺酸钠中,烷基含碳原子的个数以12~18为宜
B.生铁炼钢,目的是适当降低生铁中的含碳量,除去大部分硫、磷等杂质
C.海水提镁,通过电解熔融状态的氧化镁来制备金属镁
D.与氨碱法比较,联合制碱法优点是提高了原料的原子利用率难度: 中等查看答案及解析
-
含杂质SiO2的硫铁矿样品1克,用充足的O2燃烧后剩余固体称重为0.8克,则硫铁矿中含硫量为( )
A.10%
B.22%
C.32%
D.40%难度: 中等查看答案及解析