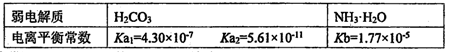-
下列说法错误的是
A.水玻璃常用于制备硅胶和木材防火剂
B.在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率
C.煤经过气化和液化两个物理变化过程,可变为清洁能源
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5分散在空气中可能形成胶体或浊液
难度: 中等查看答案及解析
-
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是
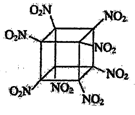
A.分子中不含有非极性键
B.1 mol该分子中含8 mol二氧化氮
C.该物质既有氧化性又有还原性
D.该物质爆炸产物是NO2、CO2、H2O
难度: 困难查看答案及解析
-
下列说法正确的是
A.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸
B.将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原性糖
C.在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应可得到NH3分子数为NA
D.标准状况下,33.6 L二氯甲烷中含有氯原子的数目为3NA
难度: 中等查看答案及解析
-
下列物质的性质比较中正确的是
A.键的极性:H2O>H2S
B.导电性:HF溶液<HC1溶液
C.燃烧热:H(C)(s,石墨)>H(CO)(g)
D.耐腐蚀性:铝<生铁
难度: 中等查看答案及解析
-
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是

A.X、Y、Z一定都是非金属单质
B.X、Y、Z一定都是金属单质
C.X、Y、Z中至少有一种是非金属单质
D.X、Y、Z中至少有一种是金属单质
难度: 困难查看答案及解析
-
下列药品和装置合理且能完成相应实验的是
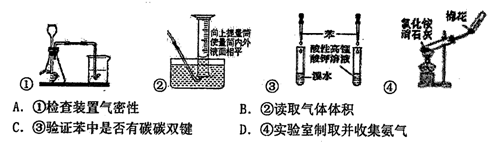
难度: 中等查看答案及解析
-
甲苯的苯环上有5个氢原子,其中若有两个氢原子分别被羟基(-OH)和氯原子(-Cl)取代,则可形成的有机物同分异构体数目有
A.9种 B.10种 C.12种 D.15种
难度: 困难查看答案及解析