-
【化学一选修2:化学与技术】(15分)三氧化二镍(Ni2O3)是一种重要的蓄电池材料。工业上利用镍废料(镍、铁、钙、镁合金为主)制取草酸镍晶体(NiC2O4-2H2O),再高温煅烧草酸镍晶体制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。下列工艺流程示意图如下;
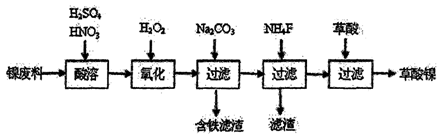
回答下列问题
(1)为提高酸溶操作中镍废料的转化率,可采取的措施有答出三条 。
(2)加入H2O2发生的主要反应的离子方程式为 。
(3)加入NH4F后除掉的杂质是____
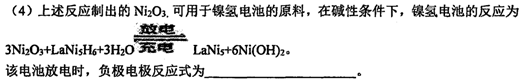
(5)工业上还可用电解法制取Ni2O3。用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2S04后采用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO—,再把二价镍氧化为三价镍。当amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为____。电解法制取Ni203的实际过程中,先获得一种结晶水合物,己知含1 mol Ni的诙结晶水合物中含有0.5 mol结晶水。取该化合物20.2 g进行充分加热,获得Ni203固体和0.2 mol水,则该结晶水合物的化学式为 .
-
【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。
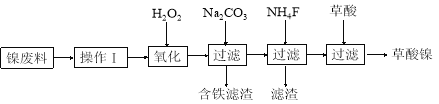
请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
-
(化学—选修2:化学与技术)
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。
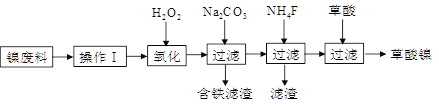
请回答下列问题:
(1)操作Ⅰ为___________________。
(2)①加入H2O2发生的主要反应的离子方程式为____________________________;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为__________________________;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为______________________________。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为__________。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_____________。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是______________________________。
-
【化学—选修2:化学与技术】
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如下所示。
请回答下列问题:
(1)操作Ⅰ为 。
(2)①加入H2O2发生的主要反应的离子方程式为 ;
②加入碳酸钠溶液调pH至4.0~5.0,其目的为 ;
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体。NiC2O4受热分解的化学方程式为 。
(4)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
-
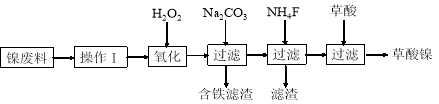
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
-
【化学—选修2:化学与技术】(15分)铁、锰、锌、铜、硼等是农作物生长必需的微量元素。某课题组研究利用废弃锌锰电池和工业废料硼镁泥生产复合微量元素肥料〔简称复合微肥)。流程如下所示:

己知:
①硼镁泥中含MgO, Na2B4O7, MnO, Fe2O3, SiO2, CaO等化合物
②MnO2不溶于硫酸和硝酸,MnO可溶于酸
回答下列问题:
(1)上述方法生产的复合微肥除了含有农作物生长必需的多种微量元素外,还含有必需的大量元素氮和 (填元素名称)。
(2)焙烧时反应的化学方程式为 ,焙烧的目的是
(3)酸解过程中气体产物可循环利用的是 ;酸解后的溶液加入硼镁泥调节溶液pH时,有H3BO3沉淀生成,该反应的离子方程式为 ;
已知: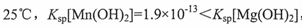 ,若溶液的pH调节到6,计算说明是否会析出Mn(OH)2, Mg(OH)2沉淀 .
,若溶液的pH调节到6,计算说明是否会析出Mn(OH)2, Mg(OH)2沉淀 .
(4)产品中锰元素含量的测定:称取ag产品,溶于适量蒸馏水中,向所得溶液中加入足量NaClO溶液,发生反应 ,过滤、洗涤、干燥后称得MnO2质量为b g,则产品中锰元素的质量分数为 。
,过滤、洗涤、干燥后称得MnO2质量为b g,则产品中锰元素的质量分数为 。
(5)己知玻璃可微量溶于水。实际生产中,常选用废玻璃、粉煤灰、炼钢炉渣和矿石等为原料高温烧制,将熔融物冷水淬冷成块,再磨成细粉即得玻璃微肥。玻璃微肥具有的优点是 (任答一条即可)。
-
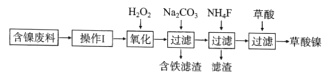
(15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6  LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
-
(14分)三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍,再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐难溶于水。根据下列工艺流程示意图回答问题。
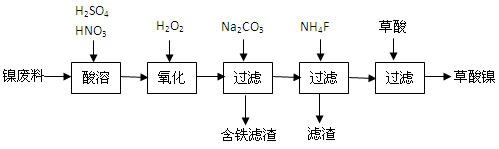
(1)生产过程中多次进行过滤。实验室进行过滤操作中用到玻璃棒,玻璃棒的作用是________。
(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0~4.5左右,加入碳酸钠溶液的作用是。再加入NH4F的目的是________。
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍受热分解的化学方程式________。
(4)工业上还可用电解法制取三氧化二镍。用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO-氧化Ni(OH)2生成三氧化二镍的离子方程式________。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是________。
(5)电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol该物质中含有0.5 mol结晶水。取该化合物20.2 g进行充分加热,而获得三氧化二镍固体和0.2 mol水,则该结晶水合物的化学式为________。
-
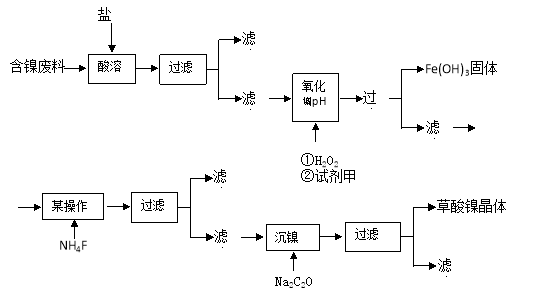
三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
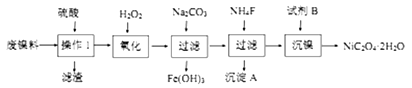
(1)操作1的名称为____________________________________。
(2)沉淀A为_________________________(用电子式表示)。
(3)试剂B的名称为_______________,沉镍后,滤液中C2O42-的浓度为0.01mol/L,则残留在滤液中的 c(Ni2+)=_______________(已知Ksp[NiC2O4]= 4×10-10)。
(4)NiC2O4·2H2O 高温煅烧制取三氧化二镍的热重曲线如右图所示:

①T3温度后,草酸镍全部转化为三氧化二镍,则a为_______________(保留一位小数)。
②T2温度发生反应的化学方程式为__________________________。
(5)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体 现象
现象 澄清石灰水变浑浊
澄清石灰水变浑浊
①试剂1的化学式为_____________________。
②碱石灰的作用是________________________________。
-
三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
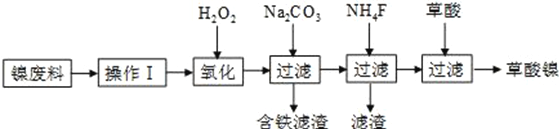
请回答下列问题:
(1)操作Ⅰ为__________________________。
(2)①加入H2O2发生的主要反应的离子方程式为_____________________________;
②加入碳酸钠溶液目的是调溶液的pH值在4.0~5.0,用化学用语回答加入碳酸钠的目的_________________________________________________________________。
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体,NiC2O4受热分解的化学方程式为___________________________________。
(4)加入草酸后如何证明沉淀完全______________________________________________;
过滤NiC2O4沉淀时如何洗涤沉淀_________________________________________________。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池负极的电极反应式为__________________________。







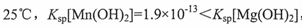 ,若溶液的pH调节到6,计算说明是否会析出Mn(OH)2, Mg(OH)2沉淀
,若溶液的pH调节到6,计算说明是否会析出Mn(OH)2, Mg(OH)2沉淀 ,过滤、洗涤、干燥后称得MnO2质量为b g,则产品中锰元素的质量分数为
,过滤、洗涤、干燥后称得MnO2质量为b g,则产品中锰元素的质量分数为



 澄清石灰水变浑浊
澄清石灰水变浑浊