-
下列物质属于纯净物的是( )
A.漂白粉
B.盐酸
C.碘酒
D.液氯难度: 中等查看答案及解析
-
下列做法不能体现低碳生活的是( )
A.减少食物加工过程
B.注意节约用电
C.尽量购买本地的、当季的食物
D.大量使用薪柴为燃料难度: 中等查看答案及解析
-
原子的种类决定于原子的( )
A.核电荷数
B.质子数和中子数
C.相对原子质量
D.核外电子数难度: 中等查看答案及解析
-
一种微粒的质子数和电子数与另一种微粒的质子数和电子数均相等,下列2种微粒间关系的说法错误的是( )
A.它们可能是不同的分子
B.可能是一种分子和一种离子
C.可能是同位素
D.可能是相同的原子难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.CO2的电子式
B.Cl-的结构示意图
C.水的结构式 H-O-O-H
D.质量数为37的氯原子难度: 中等查看答案及解析
-
下列物质中不含有氯离子的是( )
A.氯水
B.漂粉精
C.盐酸
D.液氯难度: 中等查看答案及解析
-
下列化合物不能通过单质直接化合而制得的是( )
A.CuCl2
B.AlCl3
C.FeCl2
D.NaCl难度: 中等查看答案及解析
-
下列说法正确的是( )
A.含有离子键的化合物必是离子化合物
B.含有共价键的物质就是共价化合物
C.共价化合物可能含有离子键
D.离子化合物中不含有共价键难度: 中等查看答案及解析
-
关于氧化还原反应,下列说法正确的是( )
A.被氧化的物质是还原剂
B.氧化剂被氧化,还原剂被还原
C.失去电子、化合价降低的物质是还原剂
D.氧化剂失去电子,化合价升高难度: 中等查看答案及解析
-
下列叙述中,错误的是( )
A.用四氯化碳从溴水中萃取溴,含溴的四氯化碳在下层
B.萃取是一种常用的分离物质的方法
C.用无色四氯化碳从碘水中萃取碘,含碘的四氯化碳溶液变成紫色
D.碘在酒精中的溶解度比水中大,所以可以用酒精从碘水中萃取碘难度: 中等查看答案及解析
-
能用分液的方法来分离的一组混合物是( )
A.氯化银和水的悬浊液
B.酒精的水溶液
C.四氯化碳和水的乳浊液
D.氯化钠和溴化镁的混合溶液难度: 中等查看答案及解析
-
关于如图所示装置的叙述,正确的是( )
A.铜为负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原难度: 中等查看答案及解析
-
下列关于氯水的叙述正确的是( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡放出,该气体主要是Cl2
D.氯水放置数天后pH值将变大难度: 中等查看答案及解析
-
下列物质中,不能使湿润的淀粉-碘化钾试纸变蓝的是( )
A.碘水
B.溴水
C.碘化钾溶液
D.氯气难度: 中等查看答案及解析
-
下列化学变化中,需加入氧化剂才能实现的是( )
A.C→CO2
B.KMnO4→MnCl2
C.CuO→Cu
D.SO3→H2SO4难度: 中等查看答案及解析
-
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol•L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A.S2-
B.S
C.SO32-
D.SO42-难度: 中等查看答案及解析
-
甲、乙、丙三种溶液各含有一种X(X为Cl-、Br-、I-中的一种)离子.向甲中加淀粉溶液和氯水,则溶液变为橙色,再加入丙溶液,颜色无明显变化.则甲、乙、丙依次含有( )
A.Br-、Cl-、I-
B.Br-、I-、Cl-
C.I-、Br-、Cl
D.Cl-、I-、Br-难度: 中等查看答案及解析
-
如图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )
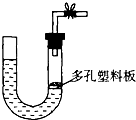
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.双氧水和二氧化锰制取氧气难度: 中等查看答案及解析
-
随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质的密度逐渐减小,颜色逐渐加深,熔、沸点逐渐降低
B.单质的氧化性逐渐增强
C.卤素阴离子的还原性逐渐增强
D.气态氢化物的稳定性逐渐增强难度: 中等查看答案及解析
-
在相同温度下,下列三个热化学方程式中Q值的关系是( )
(1)2H2(g)+O2(g)→2H2O(g)+Q1
(2)2H2(g)+O2(g)→2H2O(l)+Q2
(3)H2(g)+O2(g)→H2O(g)+Q3.
A.Q1>Q2=Q3
B.Q1=Q2=Q3
C.Q2>Q1=2Q3
D.Q1=Q3=难度: 中等查看答案及解析
-
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)→CO2(g)+393.51kJ/mol
C(金刚石)+O2(g)→CO2(g)+395.41kJ/mol
据此推理所得到的下列结论中,正确的是( )
A.相同条件下,1mol金刚石与1mol氧气的能量总和小于1mol二氧化碳气体的能量
B.1mol石墨与1mol氧气反应生成1mol液态二氧化碳,放出热量小于393.51kJ
C.由石墨制备金刚石一定是吸热反应
D.金刚石比石墨稳定难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.加热胆矾失去结晶水的过程称风化
B.在饱和溶液中,溶质溶解的速率等于结晶速率
C.从溶液中结晶析出的晶体都含有结晶水
D.从冰箱中取出一瓶可乐,表面出现水珠,这种现象是潮解难度: 中等查看答案及解析
-
下列为放热反应的化学变化是( )

A.H2O(g)→H2O(l)+44.0 kJ/mol
B.2HI(g)→H2(g)+I2(g)-14.9 kJ/mol
C.浓硫酸溶于水
D.能量变化如图所示的化学反应难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.原子晶体中可能含有共价键,离子晶体一定含有离子键
B.NaCl固体中因为有Na+和Cl-所以能导电
C.气态氢化物的熔沸点:HF>HCl>HBr>HI
D.有新单质生成的化学反应不一定都是氧化-还原反应难度: 中等查看答案及解析
-
HF气体分子间容易缔合.某HF气体由HF、(HF)2、(HF)3三者混合而成,其平均相对分子质量为42,则(HF)3的体积分数可能为( )
A.56%
B.51%
C.49%
D.10%难度: 中等查看答案及解析
