-
人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-═ZnO+H2↑,Ag2O+H2O+2e-═2Ag+2OH-.据此判断氧化银是( )
A.负极,被氧化
B.正极,被还原
C.负极,被还原
D.正极,被氧化难度: 中等查看答案及解析
-
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后( )
A.溶液的pH变大
B.c(Na+)与c (CO32-)的比值变大
C.溶液浓度变大,有晶体析出
D.溶液浓度不变,有晶体析出难度: 中等查看答案及解析
-
用物质的量都是0.1mol的CH3COOH和CH3COONa配成l L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( )
A.c(H+)<c(OH-)
B.c(CH3COOH)+c(CH3COO-)=0.2 mol•L-1
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.2 mol•L-1难度: 中等查看答案及解析
-
蒸干并灼烧下列物质的水溶液,仍能得到该物质的是( )
A.氯化铝
B.碳酸钠
C.硫酸亚铁
D.碳酸氢钠难度: 中等查看答案及解析
-
有A、B、C、D四种金属.将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀.将A、D分别投入等浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化.如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B
B.D>A>B>C
C.D>B>A>C
D.B>A>D>C难度: 中等查看答案及解析
-
下列说法正确的是( )
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减少或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现难度: 中等查看答案及解析
-
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做( )
A.阴极
B.阳极
C.正极
D.负极难度: 中等查看答案及解析
-
对处于化学平衡状态的体系,依据化学平衡与化学反应速率的关系可知下列说法正确的是( )
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.反应向正反应方向进行时,正反应速率一定增大
D.只有使用催化剂,才会出现化学反应速率变化但化学平衡不移动的情况难度: 中等查看答案及解析
-
将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经2s后测得C的浓度为0.6mol•L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol•L-1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④难度: 中等查看答案及解析
-
正常人胃液的pH在0.3~1.2之间,胃酸多了需要治疗.某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的.这说明( )
A.碳酸、酒石酸都不是强酸
B.对人而言,酒石酸是必需的营养品
C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感
D.酒石酸钠水解显酸性难度: 中等查看答案及解析
-
下列有关水的电离的说法正确的是( )
A.将水加热,KW增大,pH不变
B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大
C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小
D.向水中加少量NaOH固体,恢复到原温度,水的电离被抑制,[OH-]增大难度: 中等查看答案及解析
-
在容积不变的密闭容器中发生反应2NO2⇌2NO+O2,能说明该反应已达化学平衡状态的是( )
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③v(NO2):v(NO):v(O2)=2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体的平均相对分子质量不再改变.
A.①④⑥
B.②③⑤
C.①③④
D.④⑤⑥难度: 中等查看答案及解析
-
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应:NO2(g)+CO(g)⇌CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2.在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO的体积分数是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量.下列判断正确的是( )
A.白磷在氧气中燃烧的热化学方程式是:P4(s)+5O2(g)=P4O10(s)△H=-745.8kJ•mol-1
B.红磷转化成白磷时放出热量
C.红磷比白磷稳定
D.31g红磷中蕴含的能量为738.5kJ难度: 中等查看答案及解析
-
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH.下列说法不正确的是( )
A.浓度均为0.1mol•L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1mol•L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)变大难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用.已知某镍镉电池中电解质溶液为KOH溶液,其充放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2,有关该电池的说法错误的是( )
A.充电时阳极反应:Ni(OH)2+OH-+e-→NiOOH+H2O
B.充电过程是电能转化为化学能的过程
C.放电时负极上发生氧化反应,电极附近溶液的碱性减弱
D.放电时电解质溶液中OH-向负极移动难度: 中等查看答案及解析
-
如图是恒温下某化学反应的反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( )
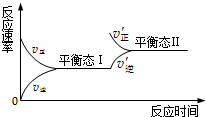
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等难度: 中等查看答案及解析
-
常温下,关于溶液的稀释说法正确的是( )
A.将1 L 0.1mol•L-1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol•L-1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6难度: 中等查看答案及解析
-
常温下列各种溶液中,可能大量共存的离子组是( )
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离出的c(OH-)=1×10-13mol•L-1的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3-
D.c(H+)=10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO-难度: 中等查看答案及解析
-
相同温度相同物质的量浓度的六种溶液:按pH值由大到小的顺序是( )
①NaHCO3 ②CH3COONa ③H3PO4 ④Na2CO3 ⑤NaHSO4.
A.③⑤②①④
B.③⑤①②④
C.④②①⑤③
D.④①②③⑤难度: 中等查看答案及解析
-
经一定时间后,可逆反应aA+bB⇌cC中物质的含量A%和C%随温度的变化曲线如图所示.下列说法正确的是( )
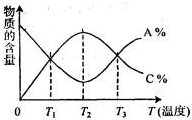
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动难度: 中等查看答案及解析
-
在一定压强不同温度(T1<T2)下,可逆反应2X(g)+Y(g)═2Z(g);△H<0中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
石灰乳中存在下列平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH- (aq),加入下列溶液,可使Ca(OH)2减少的是( )
A.Na2CO3固体
B.少许食盐固体
C.NaOH固体
D.CaCl2固体难度: 中等查看答案及解析
-
一种新型燃料电池,是用两根金属铂作电极插入KOH溶液中,然后向两极上分别通入H2和O2,下列说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为2H2O+O2+4e-4OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6LO2完全反应后有1mol电子转移难度: 中等查看答案及解析
-
100g C不完全燃烧所得产物中,CO所占体积为
,CO2为
,且:C(s)+
O2(g)═CO(g)△H=-110.35kJ•mol-1;
CO(g)+O2(g)═CO2(g)△H=-282.57kJ•mol-1.与这些碳完全燃烧相比,损失的热量为( )
A.39.292kJ
B.3274.3kJ
C.784.92kJ
D.2489.44kJ难度: 中等查看答案及解析