-
下列盐类水解的应用,不正确的是
A. 实验室配制氯化铁溶液时,滴入少量稀硫酸抑制水解
B. 为使纯碱溶液的去油污效果更好,可以使用热的纯碱溶液
C. 明矾可用于净水,是由于溶于水后产生的Al(OH)3胶体具有吸附作用
D. 铵态氮肥不能和草木灰混合施用,是由于NH4+与C032-互相促进水解,肥效下降
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离出来的c(OH-)=1×10-11mol/L,若向该溶液中滴入2~3滴酚酞,溶液的颜色可能是
A. 只显红色 B. 呈无色 C. 无色或蓝色 D. 红色或无色
难度: 困难查看答案及解析
-
化学与STSE (社会、科学、技术和环境) 密切相关,下列说法不正确的是
A. 铁表面镀锌可以增强其抗腐蚀性
B. 寻找合适催化剂能使水转化为汽油
C. 合理利用太阳能、风能和氢能等能源有利于实现“低碳经济”
D. 钢铁在潮湿的空气中更容易生锈,其主要原因是形成了原电池
难度: 中等查看答案及解析
-
下列物质的水溶液因水解而呈酸性的是
A. CuCl2 B. Na2CO3 C. CH3COOH D. KHSO4
难度: 简单查看答案及解析
-
某同学设计如下图所示原电池(盐桥中装有含琼胶的KNO3饱和溶液),该电池工作时,下列说法正确的是
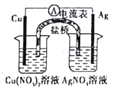
A. 盐桥中的K+移向AgNO3溶液
B. 负极反应式为: Ag-e-=Ag+
C. 铜电极上发生还原反应
D. 在外电路中,电子由银电极流向铜电极
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. NaHCO3的水【解析】
HCO3-+H2OH3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. 碳酸钙的溶解平衡:CaCO3(s)
Ca2+(aq)+CO32-(aq)
D. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH-;ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡向左移动,c(OH―)降低
B. 向水中加入少量的水,平衡向右移动,c(H+)增大
C. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D. 将水加热,c(H+)增大,c(OH―)降低,Kw增大
难度: 中等查看答案及解析
-
相同体积的c(H+) =10-2mol·L -1的盐酸溶液和醋酸溶液分别跟等质量的锌充分反应,下列说法错误的是
A. 刚开始时两种溶液中产生H2 的速率相同
B. 若有一种溶液中锌有剩余,则有剩余的是盐酸溶液
C. 若两种溶液中锌均无剩余,则两者产生等量的氢气
D. 若两种溶液中锌均有剩余,则两者产生等量的氢气
难度: 中等查看答案及解析
-
在0.1mol/L的CH3COOH溶液中,下列关系正确的是
A. c(CH3COOH) > c(H+) > c(CH3COO-) > c(OH-)
B. c(CH3COO-) > c(CH3COOH) > c(H+) > c(OH-)
C. c(CH3COOH) > c(CH3COO-)= c(H+)> c(OH-)
D. c(CH3COOH) > c(CH3COO-)> c(H+) > c(OH-)
难度: 中等查看答案及解析
-
用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液的pH减小的是
A. KCl B. NaOH C. Na2SO4 D. H2SO4
难度: 中等查看答案及解析
-
工业制备硫酸过程中存在如下反应: 2SO2+O2
 2SO3,下列关于该反应的说法正确的是
2SO3,下列关于该反应的说法正确的是A. 使用催化剂不影响反应速率 B. 降低体系温度能加快反应速率
C. 增大O2的浓度能加快反应速率 D. 一定条件下SO2能100%转化为SO3
难度: 简单查看答案及解析
-
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,以硫酸镍溶液为电解液进行粗镍提纯,下列说法正确的是(已知,氧化性的强弱顺序为Fe2+2+2+)
A. 阳极发生还原反应,电极反应式为Ni2++ 2e-=Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在金属阳离子只有Fe2+和Zn2+
D. 电解后,Cu和Pt沉积在电解槽底部形成阳极泥
难度: 中等查看答案及解析
-
常温下,下列溶液中的粒子浓度关系正确的是
A. NH4C1溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
B. Na2SO4溶液中:c(Na+) + c(H+)=c(SO42-) + c(OH-)
C. NaHCO3溶液中:c(Na+)> c(HCO3-) >c(CO32-)> c(OH-)
D. 浓度均为0.1mol/LCH3COOH 与CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH)=0.1mol/L
难度: 中等查看答案及解析
-
常温下,AgCl、AgBr、AgI的溶度积Ksp分别为1.8´10-10、5´10-13、8.3´10-17。下列有关说法错误的是
A. 常温下,在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀析出
B. 常温下,在AgCl饱和溶液中加入足量浓NaBr溶液会有AgBr沉淀析出
C. 常温下,在AgI饱和溶液中加入NaI固体会有AgI固体析出
D. 常温下,在水中的溶解能力:AgCl>AgBr>AgI
难度: 简单查看答案及解析
-
下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol/L。①H2S溶液;②KHS溶液;③K2S溶液;④H2S和KHS混合溶液。 下列说法正确的是
A. 溶液pH从大到小的顺序是:③ > ② > ① > ④
B. 在KHS溶液中有:c(H+) + c(K+) = c(OH-) + c(HS-) + c(S2-)
C. c(H2S)从大到小的顺序是:① > ④ > ③ > ②
D. 在H2S和KHS混合溶液中有:c(H2S) + c(HS-) + c(S2-) = 2c(K+)
难度: 困难查看答案及解析
-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 。 下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃条件下进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
难度: 困难查看答案及解析
-
已知H2(g)+I2(g)
2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
A. 甲、乙提高相同温度 B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强 D. 甲增加0.1molH2,乙增加0.1molI2
难度: 困难查看答案及解析
-
一种驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )
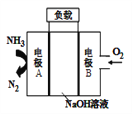
A. 电流由电极A经外电路流向电极B
B. 电池工作时,OH-向电极B移动
C. 该电池工作时,每消耗22.4L NH3转移3mol电子
D. 电极A上发生的电极反应为:2NH3-6e-+ 6OH-=N2 + 6H2O
难度: 简单查看答案及解析
-
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
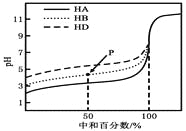
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
难度: 困难查看答案及解析


