-
请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
| pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1) 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g)  Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。

-
现有浓度均为0.1mol/L的下列溶液:①盐酸、②氢氧化钠、③氯化铵、④醋酸钠,请回答下列问题:
(1)25℃时,①、②、③、④四种溶液pH由大到小的顺序是(填序号)______.
(2)25℃,将②和④等体积混合后,混合液中各离子浓度由大到小的顺序是______.
(3)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)______25℃.在t℃时,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=______.
-
电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
| 化学式 | CH3COOH | HClO |
| 电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:
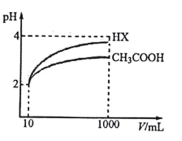
①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
-
25℃时,物质的量浓度均为0.1mol•L-1的几种盐溶液的pH如表:
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
| pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(H+)=_____mol•L﹣1,
(4)①0.100mol•L-1NH4HCO3溶液中物质的量浓度最大的离子是__________(填化学式);②CH3COOH与NaOH反应后的溶液中存在:c(Na+)<c(CH3COO-),该溶液呈_________性(填“酸”“碱”或“中”),该溶液的溶质是______。(填化学式)
(5)下列说法正确的是_____。
a.c(NH4+):①>②
b.物质的量浓度和体积均相等的NaCl和NaX两种溶液中,离子总数相等
c.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1mol•L-1
d.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(6)某同学欲用0.1mol•L-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。
-
25℃时,物质的量浓度均为0.1mol•L﹣1的几种盐溶液的pH如表:
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
| pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)写出溶液④中通少量CO2的离子方程式:_________________________.
(2)25℃时,溶液①中,由水电离产生的c(OH﹣)=_____mol•L﹣1。
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1mol•L﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=____________.(用ab表示)
-
25℃时,物质的量浓度均为0.1mol•L-1的几种盐溶液的pH如表:
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
| pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_____mol•L﹣1;Ka(CH3COOH)_____Kb(NH3•H2O)(填“>”、“<”或“=”)。
(4)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1mol•L-1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(5)某同学欲用0.1mol•L-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。
-
25℃时,物质的量浓度均为0.1mol•L﹣1的几种盐溶液的pH如表:
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
| pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1mol•L﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO 水解反应的平衡常数Kh=
水解反应的平衡常数Kh= =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO )∶c(CO
)∶c(CO )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。
-
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________
(2)④、⑤、⑥、⑦五种溶液中NH4+浓度由大到小的顺序是(填序号)________
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是________。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)________25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=。
-
现有浓度均为 0.1 mol·L-1 的下列溶液: ①硫酸 ②醋酸 ③氢氧化钠
请回答下列问题:
(1)三种溶液中由水电离出的 H+浓度由大到小的顺序是(填序号)____________。
(2)已知 T ℃, KW=1×10-13,则 T ℃_________25 ℃(填“>”、 “<”或“=”)。在 T ℃时将pH=11的NaOH溶液a L与 pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则 a∶b=____________。
(3) 25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6, y≥8),取 a L 该盐酸与 b L该氢氧化钠溶液反应,恰好完全中和,求:
①若 x+y=14,则 a/b=____________(填数据);
②若 x+y=13,则 a/b=____________(填数据);
③若 x+y>14,则 a/b=____________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH 满足关系____________(用 x、 y 表示)。
-
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
2NH3(g) △H=-92.4kJ·mol-1
4NH3(g) + 3O2(g) △H=______。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。


