-
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中
和
代表不同元素的原子。关于此反应说法错误的是( )

A. 一定属于可逆反应
B. 一定属于吸热反应
C. 一定属于氧化还原反应
D. 一定属于分解反应
难度: 中等查看答案及解析
-
油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ。油酸甘油酯的燃烧热△H为
A. 3.8×104kJ·mol-1 B. -3.8×104kJ·mol-1
C. 3.4×104kJ·mol-1 D. -3.4×104kJ·mol-1
难度: 简单查看答案及解析
-
已知分解1 mol 液态H2O2 ,生成液态H2O和氧气放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2(l)+ I-(aq)
H2O(l) +IO- (aq) △H1 反应Ⅰ
H2O2(l)+ IO-(aq)
H2O(l) +O2(g)+ I-(aq) △H2 反应Ⅱ
下列有关说法错误的是( )
A. 可以用带火星的木条检验H2O2是否开始分解
B. IO-在反应Ⅰ中是氧化产物,在反应Ⅱ中是氧化剂
C. 在H2O2溶液中加入NaIO也能提高H2O2分解速率
D. △H1+△H2
-98kJ/mol
难度: 中等查看答案及解析
-
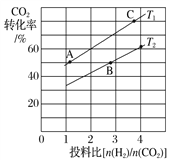
某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
难度: 困难查看答案及解析
-
关于下列各装置图的叙述中错误的是( )
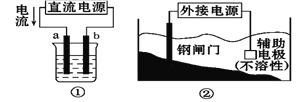

A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②中钢闸门应与外接电源的负极相连
C. 装置③的总反应式是Cu+2Fe3+=Cu2++2Fe2+
D. 装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
向含有CaCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A. Ksp(CaCO3) B. c(Ca2+) C. c(H+) D. c(CO32−)
难度: 中等查看答案及解析
-
一定条件下,CH4与 H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),设起始
=Z,在恒压下,平衡时φ(CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是
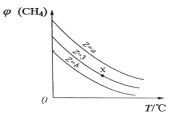
A. 该反应的焓变 ΔH>0
B. 图中 Z 的大小为 a>3>b
C. 图中 X 点对应的平衡混合物中
D. 温度不变时,图中X 点对应的平衡在加压后φ(CH4)减小
难度: 困难查看答案及解析
-
甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,反应方程式如下CH3OH(g)
HCHO(g)+H2(g),ΔH>0,T℃时,K=2.00,若CH3OH、HCHO、H2起始浓度(mol•L-1)分别为2.0、1.0、2.0,反应达到平衡时,HCHO的体积分数( )
A. 大于20% B. 等于20% C. 小于20% D. 无法确定
难度: 中等查看答案及解析
-
下列有关实验操作、实验现象和所得结论均正确的是
实验操作
实验现象
结论
A
在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液
产生大量气泡
Fe3+能催化H2O2的分解
B
用0.100mol•L-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂)
溶液由橙色变红色,且在半分钟内不恢复
滴定到达终点
C
向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液
产生黄色沉淀
溶度积:
Ksp(AgCl)<Ksp(AgI)
D
往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液
产生白色沉淀,红色褪去
证明CO32-水解呈碱性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,Ka(HCOOH)=1.77×10−4,Kb(NH3·H2O) =1.76×10−5, 浓度均为0.1 mol·L−1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和相比较( )
A. 前者大 B. 后者大 C. 两者相等 D. 无法比较
难度: 困难查看答案及解析
-
下列说法正确的是
A. NaOH溶液的导电能力一定比氨水强
B. 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH
C. 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍
D. 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半
难度: 中等查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法不正确的是

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B. 图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢
C. 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大
难度: 中等查看答案及解析
-
已知Ksp(BaF2)=1.0×10-6,若将浓度为0.1 mol•L-1的BaCl2溶液和0.22mol•L-1NH4F溶液等体积混合,下列有关叙述错误的是( )
A. 有沉淀生成,反应的离子方程式为:Ba2+ +2F-=BaF2↓
B. 反应温度不能太高,否则会导致F-浓度降低
C. 反应结束后Ba2+的浓度为0.01mol/L
D. 适当增加NH4F的比例有利于提高BaF2的产率和纯度
难度: 中等查看答案及解析
-
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法错误的是( )
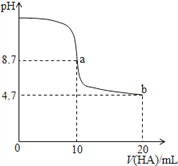
A. a点所示溶液中c(Na+)>c(A—) >c(HA)>c(H+)
B. 水的电离程度: a点>b点
C. pH=7时,c(Na+)= c(A—)+ c(HA)
D. b点所示溶液中c(A—)>c(HA)
难度: 中等查看答案及解析