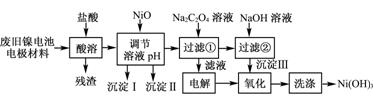
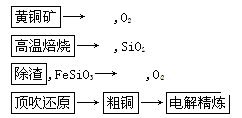
-
“绿色化学”又称环境无公害化学。下列叙述符合“绿色化学”原则的是( )
A. 绿色化学的核心是利用化学原理对工业生产造成的环境污染进行治理
B. 用聚苯乙烯等塑料代替木材生产包装盒、快餐盒等,以减少木材使用
C. 研制新型杀虫剂,使它只对目标昆虫有毒杀作用而对其他昆虫无害
D. 现代石油化工采用银作催化剂,将乙烯直接氧化生产环氧乙烷符合“原子经济”
难度: 中等查看答案及解析
-
下列有关化学用语以及化学基本概念的表述中正确的一组是( )
A. 过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同,两者互为同分异构体
B. 日本福岛核电站泄露的放射性核素Ⅰ和Cs,前者比后者少4个中子
C. 亚硫酸氢钠和碳酸氢钠的电离方程式都表示为NaHRO3Na++HRO(R=C或S)
D. 次氯酸的结构式为HOCl,过氧化氢的电子式为H+[O O]2-H+
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 氯水和过氧化钠都具有漂白作用,其漂白原理相似
B. 硅和二氧化硅都是重要的半导体材料
C. 蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程
D. MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属
难度: 中等查看答案及解析
-
下列离子方程式不正确的是( )
A. 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O
B. 将Na2O2固体投入H218O中:2H218O+2Na2O2===4OH-+4Na++18O2↑
C. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO完全沉淀:
2Ba2++NH+Al3++2SO+4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓
D. 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO+20H+===4Fe3++3O2↑+10H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 20mL 10mol·L-1的浓硝酸或浓硫酸与足量铜加热反应转移电子数均为0.2NA
B. 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA
C. 在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA
D. 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
难度: 中等查看答案及解析
-
下列离子或分子组中能大量共存,且满足相应要求的是( )
选项
离子或分子
要求
A
K+、NO、Cl-、HS-
c(K+)<c(Cl-)
B
Fe3+、NO、SO、Cl-
滴加盐酸立即有气体产生
C
NH、Al3+、SO、CH3COOH
滴加NaOH溶液立即有气体产生
D
Na+、HCO、Mg2+、SO
滴加氨水立即有沉淀产生
难度: 中等查看答案及解析
-
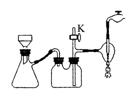
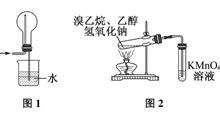
下列有关实验原理或操作正确的是( )
A. SO2气体的还原性较强,不能使其通过浓硫酸干燥
B. 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
C. 用图1装置吸收多余的HCl气体
D. 用图2装置检验溴乙烷发生消去反应生成乙烯
难度: 中等查看答案及解析
-
由短周期元素组成的中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是( )
A. 若D与盐酸反应,可生成A和B,则X一定是H2O
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B
难度: 中等查看答案及解析
-
X、Y、Z、T四种原子序数递增的短周期元素,其部分性质或结构如下:
元素编号
元素性质或原子结构
X
形成的简单阳离子核外无电子
Y
元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应
Z
元素在周期表的族序数等于周期序数的3倍
T
同周期元素中形成的简单离子半径最小
下列说法正确的是( )
A. 原子半径大小顺序:T>Z>Y>X
B. X分别与Y、Z均可形成既含极性键又含非极性键的化合物
C. T的单质与Y的最高价氧化物对应水化物的溶液不反应
D. 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用
难度: 中等查看答案及解析
-
以下4种物质是常用香精的主要成分,下列说法正确的是( )
CH3OHCHH3CCH3 CHOHCH3 COOCH3NH2 CHOCHH3CCH3
百里香酚 苏合香醇 人造橙花油 枯茗醛
A. 上述物质中只有一种成分含有1个手性碳原子
B. 鉴别百里香酚和苏合香醇可和溴水或酸性高锰酸钾溶液
C. 苏合香醇和人造橙花油均能发生加成、消去、氧化和缩聚反应
D. 与枯茗醛互为同分异构体且苯环上只有一种氢的酚类单环物质有2种
难度: 中等查看答案及解析
-
若按图甲装置进行实验,图乙中x、y分别表示流入电极的电子、某产物的物质的量。若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液,电解过程中溶液的pH随时间t变化的示意图如丙所示。则下列叙述中正确的是( )
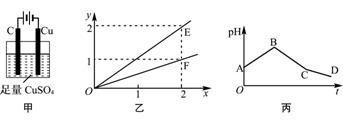
A. E表示反应生成Cu的物质的量
B. F表示反应生成H2SO4的物质的量
C. BC段阳极产物是Cl2
D. CD段电解的物质是水
难度: 中等查看答案及解析
-
下列关于各溶液的描述中正确的是( )
A. pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③
B. 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL
C. 向1.00L 0.3mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中:
3c(Na+)=2[c(HCO)+c(CO)+c(H2CO3)]
D. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-)
难度: 中等查看答案及解析
-
下列图像表达正确的是( )
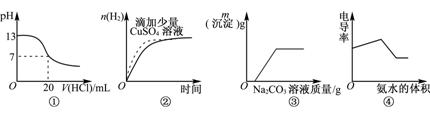
A. 图①表示25℃时,和0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液
B. 图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应
C. 图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D. 图④表示向盐酸和醋酸混合溶液中滴入氨水
难度: 中等查看答案及解析
-
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)→Na2S(s)+4H2O(g)。下列说法正确的是( )
A. 该反应的平衡常数表达式K=c(H2O)/c(H2)
B. 若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C. 若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D. 若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45%
难度: 中等查看答案及解析