-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的下列叙述中,能说明反应已达到平衡的是
A. C生成的速率与C分解的速率相等B.单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化 D. 混合气体的物质的量不再变化
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g) 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
A. x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D. G的体积分数不变
难度: 中等查看答案及解析
-
体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH 溶液中和时两者消耗NaOH 的物质的量
A.相同 B.中和NaOH的多 C.中和CH3COOH的多 D.无法比较
难度: 中等查看答案及解析
-
在48mL0.1mol/LHNO3溶液中加入12mL0.4mol/LKOH溶液时,所得到的溶液呈
A.弱酸性 B.强酸性 C.碱性 D.中性
难度: 中等查看答案及解析
-
室温下,柠檬水溶液的pH是3,其中的c(OH-)是
A.0.1mol/L B.1×10-3 mol/L C.1×10-7 mol/L D.1×10-11 mol/L
难度: 中等查看答案及解析
-
甲溶液的pH是4,,乙溶液的pH是5,甲溶液与乙溶液的c(H+)之比为
A. 10:1 B.1:10 C.2:1 D1:2
难度: 中等查看答案及解析
-
下列化学方程式中,属于水解反应的是
A.H2O+H2O
H3O++OH- B.HCO3-+OH-
H2O+CO32-
C.CO2+H2O
H2CO3 D.CO32-+H2O
HCO3-+OH-
难度: 中等查看答案及解析
-
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为
A.HX, HZ, HY B.HX, HY, HZ C.HZ, HY, HX D.HY, HZ, HX
难度: 中等查看答案及解析
-
MOH强碱溶液和等体积、等浓度的弱酸HA溶液混合后,溶液中有关离子的浓度应满足的关系是
A.c(M+)> c(OH-)> c(A-)> c(H+) B. c(M+)> c(A-)> c(H+)> c(OH-)
C. c(M+)> c(A-)> c(OH-)> c(H+) D. c(M+)> c(H+)> c(A-)> c(OH-)[
难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
难度: 中等查看答案及解析
-
在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应:2R(气)+5Q(气)
4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A 2 B 3 C 4 D 5
难度: 中等查看答案及解析
-
恒温恒压下,在容积可变的器皿中,反应2NO2(气)
N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A 不变 B 增大 C 减小 D 无法判断
难度: 中等查看答案及解析
-
水的电离过程为H2O
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14, KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃) D.水的电离是吸热的过程
难度: 中等查看答案及解析
-
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
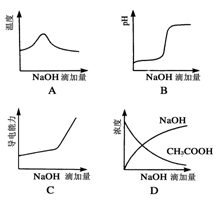
难度: 中等查看答案及解析
-
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是
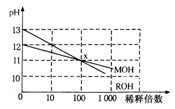
A.ROH是一种强碱 B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+) D.稀释前,c(ROH)=10c(MOH)
难度: 中等查看答案及解析
-
下列反应常温时能自发进行,并既能用能量判据又能用熵判据解释的是
A.HCl+NH3===NH4Cl
B.2KClO3===2KCl+3O2↑
C.2Na2O2+2H2O===4NaOH+O2↑
D.Ba(OH)2·8H2O+2 NH4Cl===BaCl2+ NH3+10H2O
难度: 中等查看答案及解析
-
在pH=1溶液中,下列各组离子能够大量共存的是
A Mg2+、Ca2+、HCO3-、Cl- B Na+、Ba2+、Cl-、SO42-
C K+、Fe2+、SO42-、Br- D Fe2+、Ca2+、Cl-、N O3-
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
难度: 中等查看答案及解析
-
要求设计实验证明:某种盐的水解是吸热。有四位同学作了如下回答,其中不正确的是
A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含有Fe3+的盐的水解是吸热的
C.丙同学:通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好
D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
难度: 中等查看答案及解析