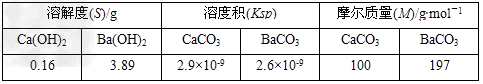
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A
Al(OH)3用作塑料的阻燃剂
Al(OH)3受热熔化放出大量的热
B
用氢氟酸蚀刻玻璃
Si02是碱性氧化物,能溶于酸
C
过氧化钠作呼吸面具中的供氧剂
过氧化钠是强氧化剂,能氧化二氧化碳
D
用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂
酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯
难度: 中等查看答案及解析
-
下列物质的保存方法正确的是( )
A. 用橡皮塞把液溴密封于玻璃瓶中
B. 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中
C. 把氯气加压液化后密封于钢瓶中
D. 氯水通常保存于无色试剂瓶中
难度: 简单查看答案及解析
-
下列叙述正确的有几个 ( )
①Li在氧气中
燃烧主要生成Li2O2
②将SO2通入BaCl2溶液可生成BaSO3沉淀
③将过量的SO2通入次氯酸钙溶液可生成次氯酸
④将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu
⑤SiO2是酸性氧化物,能与NaOH溶液反应
⑥新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
⑦CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
A.5个 B.3个 C.2个 D.1个
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是 ( )
①金属钠投入到FeC12溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向Na﹝Al(OH)4﹞溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是 ( )
A.A1Cl3 B.Na2O C.NaAl(OH)4 D.SiO2
难度: 中等查看答案及解析
-
下列各组离子或分子能
大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
NH4+、Fe2+、SO42-
少量Ba(OH)2溶液
2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O
B
Mg2+、Cl-、HCO3-
过量NaOH溶液
Mg2++2OH-=Mg(OH)2↓
C
K+、NH3•H2O,CO32-、
通入少量CO2
2OH-+CO2=CO32-+H2O
D
Fe2+、NO3-、HSO3-
NaHSO4溶液
HSO3-+H+=SO2↑+H2O
难度: 困难查看答案及解析
-
Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关
系。下表所列物质不能按如图(“→”表示一步
完成)关系相互转化的是 ( )
选项
A
B
C
D
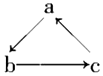
a
Na
Al
Fe
Cu
b
NaOH
Al2O3
FeCl3
CuSO4
c
NaCl
Al(OH)3
FeCl2
CuCl2
难度: 中等查看答案及解析
-
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
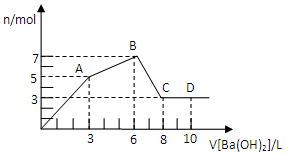
A.图中C点铝元素存在形式是AlO2—
B.向D点溶液中通人C02气体,立即产生白色沉淀
C.原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D.OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
难度: 极难查看答案及解析
-
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )

A.用装置甲氧化废液中的溴化氢
B.用装置乙分离CCl4层和水层
C.用装置丙分离CCl4和液溴
D.用仪器丁长期贮存液溴
难度: 中等查看答案及解析
-
从下列事实所列出的相应结论正确的是( )
实 验 事 实
结 论
①
SO2使酸性高锰酸钾溶液退色
可证明SO2有漂白性
②
浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液
都发生了氧化还原反应
③
取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀滴加稀盐酸,沉淀不溶解,
证明Na2SO3已氧化变质
④
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀生成
确定该溶液存在CO32-
⑤
某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝
该溶液一定有NH4+
A.②⑤ B.①② C.④⑤ D.全部
难度: 困难查看答案及解析
-
向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是
A.氯化亚铁溶液中加入双氧水 B.硫酸亚铁酸性溶液中滴加硝酸钾溶液
C.硫酸铜溶液中滴加硝酸钡溶液 D.高锰酸钾酸性溶液中滴加亚硫酸钠溶液
难度: 简单查看答案及解析
-
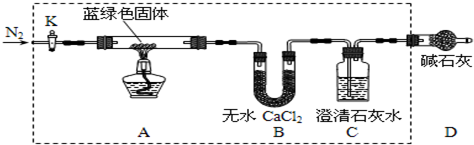
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是 ( )
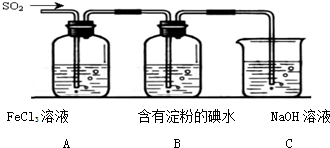
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A.向次氯酸钙溶液通过量CO2:Ca2++2Cl
O-+H2O+CO2=CaCO3↓+2HClO
B.向Ca(HCO3)2溶液中加入过量的NaOH溶液: Ca2++HCO3—+OH—=CaCO3↓+CO32—+H2O
C.酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O
D.氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—= BaSO4+H2O
难度: 中等查看答案及解析
-
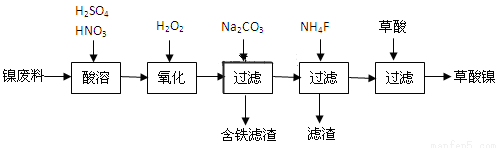
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:

已知:3NO3-+8Al+5OH-+18H2O=3NH3+8[Al(OH)4]-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中一定不含Al3+
B.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
难度: 极难查看答案及解析