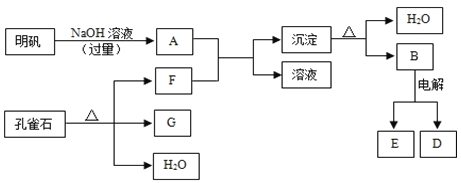
-
下列关于金属的说法中不正确的是( )
A. 合金比纯金属具有较好的性能,一般情况下,硬度比纯金属高,熔点比纯金属的低
B. 合金仍然具有金属特性
C. 常用电解法冶炼钠、镁、铝等活泼金属
D. 将钢闸门与电源正极相连,可防止其在海水中被腐蚀
难度: 中等查看答案及解析
-
下列有关金属的说法中正确的是( )
A. 钠在空气中燃烧只生成白色的氧化钠固体
B. 燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
C. 铜能与氯化铁溶液反应,该反应可以用于印刷电路板的制作
D. 铁能与硫酸发生反应,故不能用铁制容器贮存浓硫酸
难度: 中等查看答案及解析
-
向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为
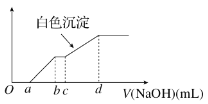
A.
B.
C.
D.
难度: 中等查看答案及解析
-
工业上真空炼铷的原理为2RbCl+Mg
MgCl2+2Rb(g),下列说法正确的是
A. 镁的金属活动性比铷强,故镁可置换铷
B. 铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性比RbCl弱
D. Rb单质比RbCl更稳定
难度: 中等查看答案及解析
-
据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:
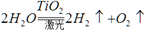 。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是A. ①② B. ③④ C. ②③ D. ①②③④
难度: 简单查看答案及解析
-
下列热化学方程式表达正确的是(
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
A. △H1>△H2>△H3
B. △H1>△H2=△H3
C. △H1<△H2<△H3
D. △H1=△H2<△H3
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 电解饱和食盐水,生成物总能量比反应物总能量高
B. 能自发进行的化学反应,不一定是△H<0,△S>0
C. “冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
D. 食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害
难度: 中等查看答案及解析
-
下列有关原电池的说法中正确的是( )
A. 电极一定要由两种不同的金属组成
B. 电子流出的一极是正极
C. 两极均发生氧化还原反应
D. 由化学能转化为电能的装置
难度: 简单查看答案及解析
-
等物质的量浓度和等体积的两份稀硫酸a和b中,分别加入过量的锌粉,并向a中加入少量硫酸铜,下图表示产生H2的体积(V)与时间(t)的关系正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2eˉ = W,Y-2eˉ=Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是
A. X>Z>Y>W B. Z>W>X>Y C. Z>X>Y>W D. Z>Y>X>W
难度: 中等查看答案及解析
-
下列基态原子或离子的电子排布式错误的是( )
A. K:1s22s22p63s23p64s1
B. F-:1s22s22p6
C. Fe:1s22s22p63s23p63d54s3
D. Kr:1s22s22p63s23p63d104s24p6
难度: 中等查看答案及解析
-
对H3O+的说法正确的是( )
A. O原子采取sp2杂化 B. O原子采取sp杂化
C. 离子中存在配位键 D. 离子中存在非极性键
难度: 简单查看答案及解析