-
下列各组物质中,互为同分异构体的是
A.O2和O3
B.
和
C.
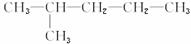 和CH3—CH2—CH2—CH2—CH2—CH3
和CH3—CH2—CH2—CH2—CH2—CH3D.CH3—CH2—CH3和CH3—CH2—CH2—CH3
难度: 中等查看答案及解析
-
下列说法正确的是
A.纤维素与淀粉互为同分异构体
B.糖类、油脂、蛋白质都是高分子化合物,一定条件下均能水解
C.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
难度: 中等查看答案及解析
-
下列反应中属于加成反应的是
A乙烯使酸性KMnO4溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴水褪色
D.甲烷与氯气混合,黄绿色消失
难度: 中等查看答案及解析
-
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是
A.气态氢化物的稳定性:HX<H2Y<ZH3
B.非金属活泼性:Y<X<Z
C.离子半径:X-<Y2-<Z3-
D.原子序数:Z>Y>X
难度: 中等查看答案及解析
-
若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
A.1 B.3 C.5 D.6
难度: 中等查看答案及解析
-
一种微粒的质子数和电子数分别与另一种微粒的质子数和电子数相同,则下列说法中错误的是
A.可能是不同的分子与原子
B.可能是不同的离子
C.可能是一种离子和一种分子
D.可能是某位素的同位素原子
难度: 中等查看答案及解析
-
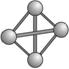
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.原子核内有10个中子的氧原子
B.乙烯的结构简式为:C2H4
C.CH4分子的比例模型:
D.CO2的电子式:
难度: 中等查看答案及解析
-
元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法正确的是
A.第一主族的元素称为碱金属
B.第二周期元素的最高化合价依次递增,并等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数一定相同
难度: 中等查看答案及解析
-
反应4NH3+5O2
4NO+6H2O在5L的密闭容器中进行,一分钟后,NO的物质的量增加了0.3mol,此反应的平均反应速率表达正确的是
A.v(O2)= 0.001mol·L-1·s-1
B.v(NO)=0.0015 mol·L-1·s-1
C.v(H2O)=0.003 mol·L-1·s-1
D.v(NH3)=0.001 mol·L-1·s-1
难度: 中等查看答案及解析
-
下面关于化学反应的限度的叙述中,正确的是
A.化学反应的限度都相同
B.可以通过改变温度控制化学反应的限度
C.可以通过延长化学反应的时间改变化学反应的限度
D.当一个化学反应在一定条件下达到限度时,反应即停止
难度: 简单查看答案及解析
-
为提纯下列物质(括号内为杂质)。所选试剂及方法均正确的是
选项
物质(括号内为杂质)
除杂试剂
方法
A
溴苯(溴)
CCl4
分液
B
硝基苯(NO2)
NaOH
分液
C
乙烷(乙烯)
氢气
洗气
D
乙醇(乙酸)
NaOH
分液
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀硫酸反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的是
A.NH4Cl
NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
难度: 中等查看答案及解析
-
下列有关元素的性质及其递变规律正确的是
A.IA族与ⅦA族元素间形成的化合物都是离子化合物
B.第三周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子从上到下还原性减弱
D.同周期金属元素的化合价越高,其原子失电子能力越强
难度: 中等查看答案及解析
-
将固体NH4Br置于密闭容器中,在某一温度下,发生下列反应:NH4Br(g)
NH3(g) + HBr(g)
2HBr(g)
H2(g) + Br2(g) ,两分钟后测得c(H2)为0.5mol/L-1,c(HBr)为4mol/L-1,若NH4Br的分解速率用v(NH3)表示,下列速率正确的是
A.0.5mol·L-1·min-1 B .2.5 mol·L-1·min-1
C.2 mol·L-1·min-1 D.5 mol·L-1·min-1
难度: 中等查看答案及解析
-
少量铁片与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
难度: 中等查看答案及解析
-
可逆反应2NO2
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2②用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②③⑤ C.①③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列递变情况中正确的是
A.HF、HCl、HBr、HI的沸点依次升高
B.HF、HCl、HBr、HI还原性依次增强
C.HF、HCl、HBr、HI稳定性依次增强
D.HF、HCl、HBr、HI酸性依次增强
难度: 中等查看答案及解析
-
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2→2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+ ④1 mol CH3OH完全反应转移12 mol电子 ⑤正极反应:O2+4e-+2H2O==4OH- ⑥该电池的电解质溶液可能是碱液。其中正确的是
A.①②⑥ B.②③④⑤ C.③ D.①③
难度: 中等查看答案及解析
-
现有M、X、A、E4种元素的单质,能发生以下反应
①在水溶液中,M+X2+=M2++X
②A+2H2O(冷)===A(OH)2+H2↑
③X、E相连浸入稀H2SO4中,电极反应为:X-2e-=X2+,2H++2e-=H2↑
判断它们的还原性由强到弱的顺序是( )
A.M、X、A、E B.A、M、X、E C.M、X、E、A D.E、A、M、X
难度: 中等查看答案及解析
-
A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,他们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4。E原子半径是短周期元素原子半径最大的。则下列叙述正确的是
A.C和D能形成D2C2的离子化合物
B.由A、D原子构成的分子的结构是正四面体
C.E和C只能形成E2C一种化合物
D.由A、B、C、D四种元素形成的化合物可以是离子化合物
难度: 中等查看答案及解析
-
下列说法中正确的是
A.放热反应不一定不需要加热,但吸热反应一定需要加热
B. 中和反应都是放热反应
C.氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低
D.C与CO2反应是吸热反应
难度: 中等查看答案及解析
-
关于原子结构、元素性质的说法正确的是
A.非金属元素组成的化合物中只含共价键
B.IA族金属元素是同周期中金属性最强的元素
C.元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析