-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
将稀硫酸和Na2S反应生成的气体通入AgNO3与AgCl组成的浊液中
Ksp(AgCl)>Ksp(Ag2S)
B
室温下,向浓度均为0.1mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。
Ksp(BaSO4)>Ksp(CaSO4)
C
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色
Fe3+的氧化性比I2的强
D
室温下,用pH试纸测得0.1mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5。
HSO3-结合H+的能力比SO32-的强
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )
强电解质
弱电解质
酸性氧化物
碱性氧化物
A
H2SO4
CH3COOHCH3COOH
NO2
Na2O
B
BaSO4
HClO
Mn2O7
CaO
C
NaCl
氨水
SO2
MnO2
D
HI
HF
CO2
Fe3O4
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
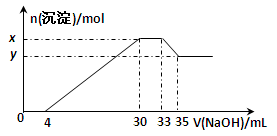
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B. 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C. 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D. 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 中等查看答案及解析
-
化学与环境.材料.信息.能源关系密切,下列说法中不正确的是
A. 高铁酸钾(K2FeO4)是一种新型.高效.多功能水处理剂,既能杀菌消毒又能净水
B. “光化学烟雾”.“臭氧空洞”的形成都与氮氧化合物有关
C. 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨
D. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA
C. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是( )
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是:
A. Cl2通往NaOH溶液中:Cl2+OH-=Cl-+ClO-+H2O
B. NaHCO3溶液中加入HCl:CO32-+2H+=CO2↑+H2O
C. AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O =AlO2-+4NH4++2H2O
D. Cu溶液于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
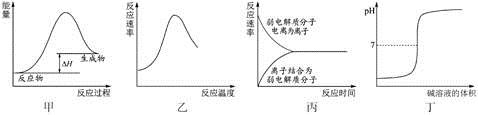
A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示弱电解质在水中建立电离平衡的过程
D. 图丁表示强碱滴定强酸的滴定曲线
难度: 简单查看答案及解析
-
下列实验不能达到预期目的是

A. 实验①:挤出胶头滴管中的NaOH溶液,观察Fe(OH)2沉淀的颜色
B. 实验②:继续煮沸溶液至红褐色,停止加热,当光束通过体系时产生丁达尔效应
C. 实验③:通过观察酸性KMnO4溶液紫色褪去,确认有乙烯生成
D. 实验④:控制一定温度,将石油分离为汽油、柴油等
难度: 中等查看答案及解析
-
用H2O2溶液处理含NaCN的废水的反应原理为NaCN + H2O2 + H2O = NaHCO3 + NH3 ,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是( )
A. 该反应中氮元素被氧化
B. 该反应中H2O2作还原剂
C. 0.1mol·L-1NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023
D. 实验室配制NaCN溶液时,需加入适量的NaOH溶液
难度: 中等查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
下列说法正确的是
A. 有质子的微粒一定有中子
B. 通常所说的氢元素是指
H
C. 16O中的“16”表示氧元素的近似相对原子质量
D. 根据反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O得到的Cl2,其相对分子质量为73.3
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物 B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子 D. 还原剂与氧化剂的物质的量之比为1:4
难度: 简单查看答案及解析
-
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项
试剂
试纸
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
紫色石蕊试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A. A B. B C. C D. D
难度: 简单查看答案及解析