-
根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是
A. 厨房清洁剂 醋 肥皂 厕所清洁剂
B. 厕所清洁剂 厨房清洁剂 醋 肥皂
C. 醋 厕所清洁剂 肥皂 厨房清洁剂
D. 厕所清洁剂 醋 肥皂 厨房清洁剂
难度: 中等查看答案及解析
-
能促使水的电离平衡正向移动,而且所得溶液呈酸性的是
A. 将水加热到100℃时,水的pH=6 B. 向水中滴加少量NaHSO4溶液
C. 向水中加入少量NH4Cl D. 向水中加入少量碳酸氢钠
难度: 中等查看答案及解析
-
分别将下列物质:①FeCl3②CaO ③NaCl ④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
A. ②③ B. ③⑥ C. ①④ D. ⑤⑥
难度: 中等查看答案及解析
-
一定温度下,将足量的AgCl分别加入下列物质中,①20mL 0.01 mol•L-1 KCl; ②30 mL 0.02 mol•L-1 CaCl2溶液; ③40 mL 0.03 mol•L-1 HCl溶液;④10 mL蒸馏水;⑤50 mL 0.05 mol•L-1 AgNO3溶液;则AgCl的溶解度由大到小的排列顺序是
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
难度: 中等查看答案及解析
-
某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)
2C(g)测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
A. 平衡不移动
B. 平衡向逆反应方向移动
C. 新平衡时各物质的浓度都比原平衡时增大
D. C的质量分数减小
难度: 困难查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
难度: 困难查看答案及解析
-
下列叙述中与盐类的水解有关的是( )
①明矾和FeCl3可作净水剂,②为保存FeCl3溶液,要在溶液中加少量盐酸,③实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释,④NH4Cl与ZnCl2溶液可作焊接中的除锈剂,⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞,⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂,⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A. ①④⑦ B. ②⑤⑦
C. ③⑥⑦ D. 全有关
难度: 简单查看答案及解析
-
在一恒温、恒容的密闭容器中发生反应A(s)+2B(g)
C(g)+D(g),当下列物理量不再变化时,能够表明该反应已达平衡状态的是
A. 混合气体的压强
B. 混合气体的平均相对分子质量
C. A的物质的量浓度
D. 气体的总物质的量
难度: 中等查看答案及解析
-
已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
难度: 简单查看答案及解析
-
下列各环境下的离子组合能够大量共存的是
A. 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+
B. 滴加石蕊试液显红色的溶液:Na+、NO3-、NH4+、K+
C. pH=1的溶液:Fe2+、Na+、Mg2+、NO3-
D. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
难度: 中等查看答案及解析
-
25℃时,0.1 mol/L的某一元酸HA溶液中
。下列说法正确的是
A. 25℃时,0.1 mol/L的HA溶液pH=4
B. 将pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH一)>c(H+)
C. 将浓度均为0.1 mol/L的HA和NaA溶液等体积混合,若所得溶液呈酸性,则: c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D. 10mL0.2mol/L HA溶液与10mL 0.1 mol/L NaOH溶液混合后,所得20mL溶液中:c(H+)﹢c(HA)﹣c(OH-)=0.05 mol/L
难度: 困难查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A. 25 ℃时,向0.1 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH)>c(SO
)>c(OH-)=c(H+)
B. 25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol·L-1
C. 0.1
溶液:
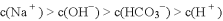
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.
<1.0×10-7mol/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是
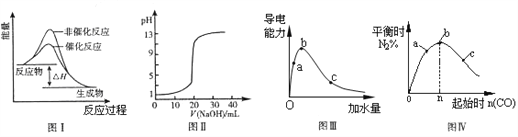
A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
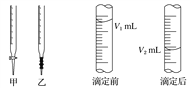
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
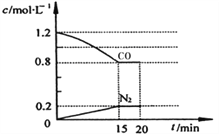
D. 图Ⅳ表示反应4CO(g)+2NO2(g )
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
难度: 困难查看答案及解析
-
已知下列三种气态物质之间的反应:
C2H2(g)+H2(g)
C2H4(g)①
2CH4(g)
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
C(s)+2H2(g)=CH4(g) ΔH=-Q1kJ/mol
C(s)+
H2(g)=
C2H2(g) ΔH=-Q2kJ/mol
C(s)+H2(g)=
C2H4(g) ΔH=-Q3kJ/mol
Q1、Q2、Q3均为正值,下列关系正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 pH<7的NaHSO3溶液中:c(HSO)>c(H2SO3)>c(SO
)
B. 10 mL 0.5 mol·L-1 CH3COONa溶液与10 mL 1 mol·L-1盐酸混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
C. 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO)+c(OH-)+c(CO
)
D. c(NH)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
难度: 困难查看答案及解析