-
化学知识在生产和生活中有着重要的应用。下列说法正确的是( )
A. 危化品仓库中的金属钠、钾着火时,可用水扑灭 B. 自来水厂常用明矾作为天然水的消毒剂
C. 纯碱在医疗上是治疗胃酸过多的一种药剂 D. 氧化铝可用来制造耐高温的实验仪器
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 100g质量分数为46%的乙醇水溶液中,含有4NA个氧原子
B. 1mol Cl2溶于水,溶液中Cl-、HClO、ClO- 粒子数之和小于2NA
C. 2.24 L(标准状况)2H2中含有0.2NA个中子
D. 25℃时Ksp(CaSO4)=9×10-6,则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的某种单质是自然界中最硬的物质,X的某种单质是生物呼吸必需的气体,Y是活泼的金属元素,Z元素原子的K层和M层电子数相同。下列说法正确的是( )
A. X、Y、Z的简单离子半径由大到小的顺序是Y>Z>X
B. 含有Y的盐溶液可能呈酸性、碱性或中性
C. W的简单氢化物的热稳定性比X的强
D. WX2跟X、Y形成的化合物发生的反应都不是氧化还原反应
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A. 环己烷的二氯代物和十氯代物均只有4种 B. 油脂在水解过程中发生了加成反应
C. 蔗糖是葡萄糖的同系物 D. 溴水可用来区分乙醇、乙酸、苯
难度: 中等查看答案及解析
-
一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是

A. 陶瓷片允许水分子通过
B. 电池充电时,阴极反应为Li++e-=Li
C. 电池放电时,N极发生氧化反应
D. 电池充电时,接线柱B应与外接直流电源的负极相连
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确但两者不具有因果关系的是
选项
实验
现象
结论
A
向NaAlO2溶液中持续通入气体CO2
产生白色沉淀,且沉淀不消失
CO2是酸性氧化物
B
向某溶液中加入Cu和浓H2SO4
试管口有红棕色气体产生
原溶液中含有NO3-
C
将镁片投到NH4 Cl溶液中
产生大量气泡
NH4 Cl水解,溶液呈酸性
D
向浓度均为0.1 mol/L的MgCl2和CuCl2的混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp [Mg (OH)2] >Ksp[Cu(OH)2]
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )
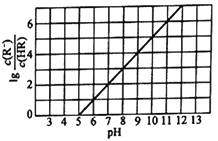
A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
难度: 困难查看答案及解析