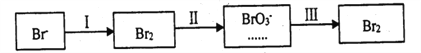
-
下列叙述不正确的是
A. 用电子式表示HCl的形成过程:
B.
Ho中的原子核内的中子数是99
C. 在空气中加热金属锂:4Li+O2
2Li2O
D. 溴化铵的电子式:
难度: 简单查看答案及解析
-
下列各组离子在指定条件下可能大量共存的是
A. 常温下水电离出的c(H+)水·c(OH-)水=10-20的溶液中:Na+、Cl-、S2-、SO32-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 不能使酚酞试液变红的无色溶液中:Na、CO32-、K+、ClO-
D. 无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是
A. 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5 NA
B. 1mo HNO3见光分解,转移的电子数为4NA
C. 向含FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
D. 在常温常压下,2.8gN2和CO的混合气体所含电子数为1.4NA
难度: 困难查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g) + I2(g)
2HI(g) ΔH=-a kJ·mol-1
已知:
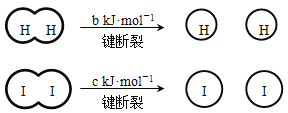 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
难度: 困难查看答案及解析
-
下列对应关系正确的是
化学性质
实际应用
A
SO2具有还原性
用SO2漂白纸浆
B
Fe3+具有氧化性
硫酸铁可用作净水剂
C
维生素C易被氧气氧化
用作食品抗氧化剂
D
H2O2受热或光照易分解
双氧水用作医疗上的消毒剂
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

A. 用装置甲制取氯气
B. 用装置乙除去氯气中的少量氯化氢
C. 用装置丙分离二氧化锰和氯化锰溶液
D. 用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 简单查看答案及解析
-
下列反应的离子方程式书写不正确的是
A. 用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3-
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
C. 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++SO42-+4OH-=AlO2-+2BaSO4↓+2H2O
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知X的最低负价与Y的最髙正价代数和为零,下列说法正确的是
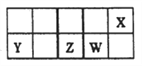
A. X分别与Z、W形成的化合物熔点顺序:Z>W
B. 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(W)
C. Z的最高价氧化物的水化物酸性比W的强
D. X的简单气态氢化物的稳定性比W的弱
难度: 中等查看答案及解析
-
一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
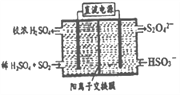
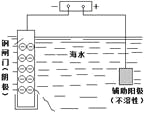
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
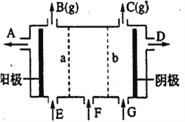
A. b是阴离子交换膜,允许Na+通过
B. 从A口出来的是H2SO4溶液
C. 阴极反应式为 4OH--4e-=2H2O+O2↑
D. Na2SO4溶液从G口加入
难度: 困难查看答案及解析
-
下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
选项
微粒组
所加试剂
离子方程式
A
NH4+、Mg2+、SO42-
少量Ba(OH)2溶液
NH4++SO42-+Ba2++OH-=BaSO4+NH3·H2O
B
Mg2+、HCO3-、Cl-
过量NaOH溶液
Mg2++2HCO3-+4OH-=Mg(OH)2↓
+2CO32- +2H2O
C
Fe2+、NO3-、 Cl-
NaHSO4溶液
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D
K+、NH3·H2O、CO32-
通入过量CO2
NH3·H2O+CO2==NH4++HCO3-
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列关于下列元素及其化合物的说法正确的是
A. 将等物质的量的①Na②Na2O③Na2O2④NaOH⑤Na2CO3露置于空气中,最后质量变化由小到大的顺序⑤<④<③<①<②
B. Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
C. 将澄清石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无明显现象
D. 在反应4FeCl2+4 Na2O2+6H2O=4 Fe(OH)3+O2↑+8NaCl中,做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为1:3
难度: 困难查看答案及解析
-
常温下,向20.00mL0.100mol·L-1NH4Cl溶液中逐滴加入0.100 mol·L-1NaOH溶液,溶液的pH与NaOH溶液所加入体积的关系如图所示(不考虑挥发)。下列说法正确的是
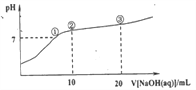
A. 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B. 点②所示溶液中:c(Cl-)>c(Na+)>c(NH4+)>c(NH3·H2O)
C. 点③所示溶液中:c(Cl-)>c(NH3·H2O)>c(OH-)>c(NH4+)
D. 整个过程中可能出现:c(OH-)+c(Cl-)= c(NH4+)+c(NH3·H2O)
难度: 困难查看答案及解析
-
下列图示内容的对应说明错误的是
A
B
C
D
图示
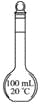
说明
该仪器用于配制一定质量分数的溶液
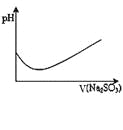
表示溴水中滴入Na2SO3溶液的pH
变化曲线该装置可保护钢闸门不被腐蚀
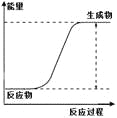
该化学反应为吸热反应
难度: 中等查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g) +Y(g)
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
下列说法不正确的是
A. 反应前2min的平均速率v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
难度: 困难查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大。己知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是
A. 简单离子的半径:B>C>D>A B. B与C形成的化合物在水溶液中能稳定存在
C. C与D不可能形成化合物C2D2 D. B与D形成的化合物溶于水所得溶液显酸性
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是
选项
实验
现象
结论或解释
A
向黄色的Fe(NO)3溶
液中滴加氢碘酸
溶液变为紫红色
氧化性:Fe3+>I2
B
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落下来
铝箔表面有致密Al2O3薄膜,
A12O3且熔点高于Al
C
向新收集的酸雨中滴加硝酸钡溶液
产生白色沉淀
酸雨中一定含有SO42-
D
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列说法正确的是
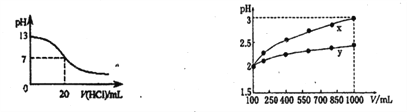
A. 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B. 左图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy
难度: 困难查看答案及解析
-
球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
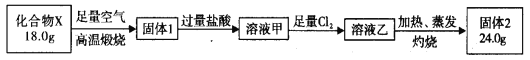
下列说法不正确的是
A.固体2是氧化铁
B.X的化学式可以表示为Fe3C2
C.溶液甲加热、蒸发、灼烧也可得到24.0g固体
D.X与足量的热浓硝酸反应有NO2和CO2生成
难度: 困难查看答案及解析