-
《中华人民共和国大气污染防治法》于2016年1月1日起实施。为保护和改善大气环境,下列做法不应该提倡的是
A.开发生物质能替代化石燃料 B.向高空排放金属冶炼产生的粉尘
C.用催化转化技术处理汽车尾气 D.大力推广生产和使用无氟冰箱
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.质子数和中子数均为6的碳原子:
B.硫离子的结构示意图:
C.氢氧化钠的电子式:
D.2-丙醇的结构简式:
难度: 中等查看答案及解析
-
下列说法正确的是
A. 因为氢氟酸显弱酸性,可用于雕刻玻璃
B. 因为液态氨气化时吸热,可用液态氨作制冷剂
C. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
D. 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应
难度: 中等查看答案及解析
-
下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
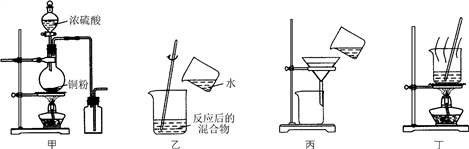
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
难度: 困难查看答案及解析
-
X、Y、Z、W都是周期表中前20号元素。Y、W同周期,Z、W同主族:X2+与Z2-具有相同的电子层结构,Z中核外电子数是W中核内质子数的2倍:Y的同素异形体之一是地球上天然存在的硬度最大的物质。下列叙述正确的是
A. 原子半径大小顺序X>Z>W>Y B. 氢化物的沸点高低顺序:Z>W
C. 元素非金属性强弱顺序:W>Z>Y D. 化合物XW与XW2中化学键类型完全相同
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Cu与FeCl3溶液的反应:Cu+2Fe3+=Cu2++2Fe2+
B.Na2SiO3溶液中加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C.AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-=AgI↓
D.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.
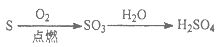
B.
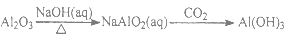
C.

D.
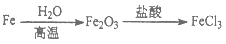
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. c(I-)=0.lmol·L-1的溶液中:Na+、Mg2+、ClO-、SO42-
B. 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C. 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl-
D. 由水电离产生的c(OH-)=l×10-10mol·L-1的溶液中:Ba2+、K+、NO3-、Br-
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是

A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 简单查看答案及解析
-
某化合物丙是药物中间体,其合成路线如下:
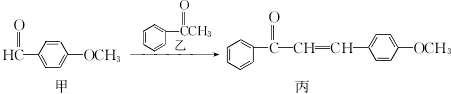
下列有关叙述不正确的是
A. 甲和丙均能使酸性高锰酸钾褪色
B. 核磁共振氢谱可以区分乙和丙
C. 乙与足量H2加成所得的产物分子中有2个手性碳原子
D. 1mol甲在一定条件下最多与4 mol氢气发生加成反应
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 25℃时,pH=4.5的硫酸溶液中c(H+)是pH=5.5的磷酸中c(H+)的10倍
B. 因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 常温下,2NO(g)+O2(g)
2NO2(g)能够自发进行,则该反应的△H<0
难度: 中等查看答案及解析
-
下列设计的实验方案能达到实验目的是

A. 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B. 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C. 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D. 检验淀粉是否水【解析】
取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象难度: 中等查看答案及解析
-
25℃时,下列溶液中粒子的物质的量浓度关系正确的是
A.0.1 mol·L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)> c(H+)>c(OH-)
B.20 mL 0.1 mol·L-1 CH3COONa溶液与10 mL 0.1 mol·L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)> c(OH-)
C.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)>c(Na+) +c(OH-)
D.向浓度为0.1mol·L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
难度: 困难查看答案及解析
-
—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器
温度/K
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
CO2(g)
H2(g)
C2H5OH(g)
H2O(g)
C2H5OH(g)
甲
500
0.20
0.60
0
0
0.083
乙
500
0.40
1.20
0
0
丙
600
0
0
0.10
0.30
0.039
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的小
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
难度: 中等查看答案及解析
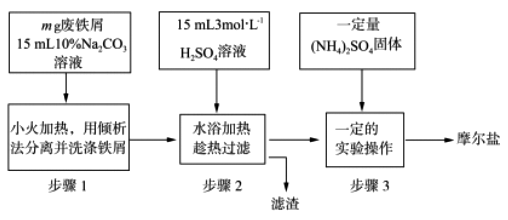
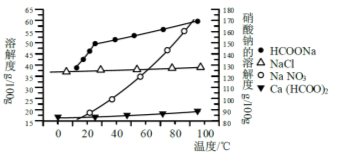

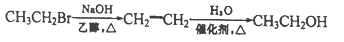 __________
__________