-
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列说法正确的是( )
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 放电时,负极反应为Zn+4OH—2e- =Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
常温下,下列有关电解质溶液的说法正确的是( )
A. pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH减小2
B. pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度
C. 0.2mol CO2通入1L0.3mol·L-1 KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-)
D. 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
难度: 困难查看答案及解析
-
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为( )
A. 1 B. 3 C. 4 D. 6
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是( )
A. 第一电离能:④>③>②>① B. 原子半径:④>③>②>①
C. 电负性:④>③>②>① D. 最高正化合价:①>③>②>④
难度: 困难查看答案及解析
-
NH3、H2O、CH4三分子中键角大小顺序正确的是( )
A. NH3>H2O>CH4 B. CH4 > NH3>H2O
C. CH4 > H2O >NH3 D. H2O > CH4 >NH3
难度: 简单查看答案及解析
-
Cl2O与OF2互为等电子体,均能与水反应(与水解反应原理类似),Cl2O与水反应的化学方程式为Cl2O+H2 O =2HClO。下列说法正确的是( )
A. Cl2O与水的反应属于氧化还原反应
B. OF2、Cl2O分子的立体构型均为直线形
C. Cl2O分子中的共用电子对偏向Cl,OF2分子中的共用电子对偏向F
D. OF2与水反应的化学方程式为OF2+ H2O=2HF+ O2
难度: 中等查看答案及解析
-
下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. 全部 B. 除①④⑥以外 C. ③④⑤⑥ D. ②⑤⑥
难度: 困难查看答案及解析
-
一定温度下,可逆反应2NO2(g)
2NO(g)+O2(g)在容积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2,同时生成2n molNO2
②单位时间内生成n molO2,同时生成2n molNO
③用NO2、NO、O2的物质的量浓度变化的反应速率之比为2:2:1
④混合气体的压强不再改变 ⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A. ①④⑤⑥ B. ①②③⑤ C. ②③④⑥ D. 以上全部
难度: 困难查看答案及解析
-
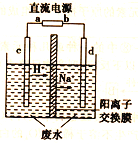
传感器可以检测空气中SO2的含量。传感器的工作原理如图所示,下列叙述正确的是( )
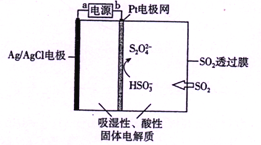
A. a为电源的负极
B. 负极的电极反应式:Ag-e-+Cl-= AgCl
C. 阴极的电极反应式:2HSO3-+2H++2e- = S2O42-+2H2O
D. 当电路中转移电子的物质的量为5×10-5mol时,进入传感器的SO2为1.12mL
难度: 困难查看答案及解析
-
250C时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4.下列关系式中正确的是( )
A. a2=a3<a4<a1 B. a3=a2<a1<a4 C. a2<a3<a1<a4 D. a1<a2<a3<a4
难度: 困难查看答案及解析
-
已知:2SO2(g)+O2(g)
2SO3(g) △H=Q(Q<0),向同温、同体积的三个真空密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2 和0.5molO2;(丙)2molSO3;恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙<2p乙
B. SO3的质量m:m甲=m丙<2m乙
C. c(SO2)与c(O2)之比k:k甲=k丙>2k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
难度: 困难查看答案及解析
-
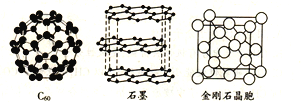
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 60g水晶晶体中,含有“Si—O”键的数目为2NA
B. 14g氮气含有
键的数目为2NA
C. 18g冰中含有的氢键数目为2NA
D. 12g金刚石中含有C—C键的数目为4NA
难度: 简单查看答案及解析
-
下面的排序不正确的是( )
A. 四卤甲烷晶体的熔点由低到高:CF4<CCl4<CBr4<CI4
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
难度: 中等查看答案及解析
-
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是
物质
NaCl
AlF3
AlCl3
MgCl2
CO2
SiO2
熔点/℃
801
1291
190(2.5×105Pa)
714
-56.5
1723
A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
难度: 中等查看答案及解析