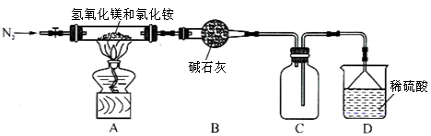
-
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用酒精洗涤粘有硫粉的试管 ③用托盘天平称量10.1g氯化钠晶体 ④实验中不慎将手指划破,可立即用FeCl3溶液止血 ⑤用瓷坩埚熔融NaOH ⑥用饱和NaHCO3溶液除去CO2中的少量SO2
A.①②③④ B.③④⑥ C.③④⑤ D.③⑤⑥
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g) ==2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1
B.若C(石墨,s) ===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D.已知2C(s)+2O2(g) ===2CO2(g) ΔH1;2C(s)+O2(g) =2CO(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.加水稀释C(OH‾)/C(H+)增大的溶液:K+、Na+、SO42-、[Al(OH)4]-
B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
难度: 困难查看答案及解析
-
下列有关结构和性质的说法正确的是
A.元素铯的两种核素137Cs比133Cs多4个质子
B.元素P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.元素原子的最外层电子数越多,越容易得电子
D.比黄金还贵的18O2和普通的16O2是两种不同的核素
难度: 中等查看答案及解析
-
下列叙述错误的是
A.铝热反应中可得到铁,但工业上不用该反应来大量生产铁
B.可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者原理相同
D.生成盐和水的反应不一定是中和反应
难度: 中等查看答案及解析
-
下列有关说法,不正确的是
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
A.仅①③④⑤ B.仅②③④
C.仅①③④ D.仅①②④⑤
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
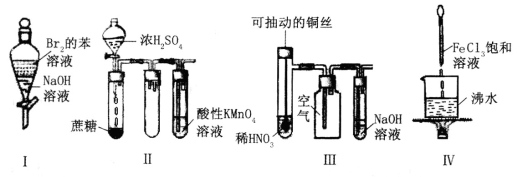
A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中无明显现象
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或实验结论一致的是
选项
实验操作及现象
实验目的或结论
A
测同浓度的Na2CO3、CH3COONa 溶液的PH值前者大
酸性强弱:CH3COOH 比H2CO3强
B
向Na2SiO3溶液中通入CO2 出现浑浊
非金属性强弱:C>Si
C
向某溶液加入盐酸酸化的氯化钡溶液有沉淀产生
说明此溶液中一定含SO42‾
D
比较H2O和H2S的沸点前者大
非金属性:O>S
难度: 中等查看答案及解析
-
W、X、Y、Z是短周期元素,其部分性质如下表
W
单质是淡黄色固体
X
在地壳中的含量居第二位
Y
原子最外层电子数是电子总数的2/3
Z
第三周期原子半径最小的金属
下列说法正确的是
A.Z的氧化物属于碱性氧化物
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.气态氢化物的热稳定性:X>W
难度: 中等查看答案及解析
-
下列叙述正确的是
A.酸性氧化物和碱性氧化物都是电解质
B.将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C.电化学腐蚀是造成金属腐蚀的主要原因
D.离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中
难度: 中等查看答案及解析
-
下列化学事实的描述或解释正确的是
A.Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)===c(OH-)
B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-==CO32-+H2O
C.有些化学反应既属于复分解反应又属于氧化还原反应
D.常温下,将pH=3的HA和PH=11的BOH等体积混合后PH>7,可能生成了弱酸强碱盐
难度: 中等查看答案及解析
-
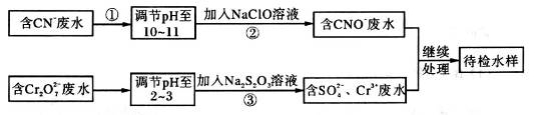
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:Ka ∶Kh=Kw
A.①④ B.①②④ C.②③ D.③④
难度: 困难查看答案及解析
-
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
2 min末浓度/mol·L-1
0.08
a
b
平衡浓度/mol·L-1
0.05
0.05
0.1
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
难度: 中等查看答案及解析
-
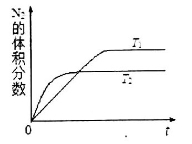
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)
2 C(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。
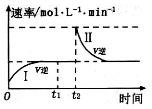
下列说法正确的是
A.0~ t2时,v正>v逆
B.I、Ⅱ两过程达到平衡时,A的体积分数I>II
C.t2时刻改变的条件是向密闭容器中加C
D.I、II两过程达到平衡时,平衡常数I<II
难度: 中等查看答案及解析
-
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质
NaF
NaClO
Na2CO3
pH
7.5
9.7
11.6
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
难度: 困难查看答案及解析
-
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示
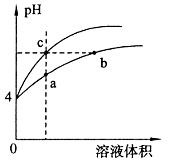
下列判断正确的是
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)===c(OH-)
C.a、b、c三点溶液中水的电离程度a>b>c
D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc
难度: 中等查看答案及解析