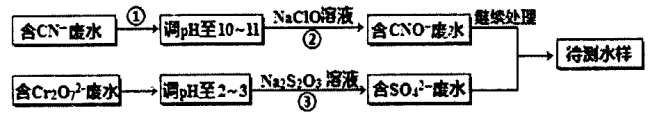-
某工业废水含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理拟用下列流程进行处理:
回答下列问题:
(1)步骤②中,CN﹣被ClO﹣氧化为CNO﹣的离子方程式为 .
(2)步骤③的反应方程式为S2O32﹣+Cr2O72﹣+H+→SO42﹣+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72﹣,反应中S2O32﹣失去e﹣ mo1.
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是 .
(4)在25℃下,将a mol•L﹣1的NaCN溶液与0.01mol•L﹣1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示CN﹣的水解常数Kh= mol•L﹣1.若25℃时将浓度均为0.1mol•L﹣1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是(填字母).
a.此溶液一定有c(Na+)+c(H+)=c(OH﹣)+c(CN﹣)
b.此溶液一定有c(Na+)=c(HCN)+c(CN﹣)
C.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用Cr2O72﹣通过下列方法测定某锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnCl2中加入过量的FeCl3溶液,用b mol/L K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72﹣可被还原为Cr3+),共用去K2Cr2O7溶液m mL.则锡粉中锡的质量分数是 .(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
-
【选修2 :化学与技术】
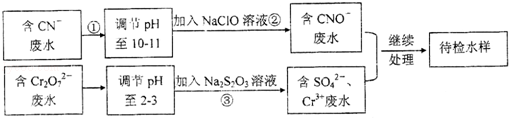
某工厂的镀铜废水中含有CN-和Cr2O72一离子,需要处理达标后才能排放。该厂拟用下列流程进行废水处理,回答下列问题:
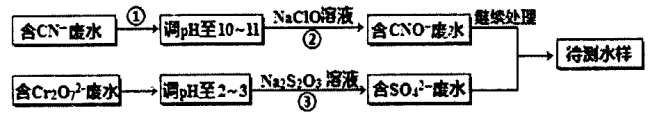
(1)流程中可用pH 试纸测定溶液的pH,pH试纸的使用方法是_______________;
(2)步骤②中反应无气体放出,该反应的离子方程式为____________;
(3)步骤③中,每处理1.0molCr2O7—时转移电子数为6NA,该反应的离子方程式为_____________;
(4)取少量待测水样于试管中,加入NaOH 溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,产生该现象对应的离子方程式为_________。
(5)含氰化物的废水必须经检测达标后(排放标准为CN—的含量<0.5mg/L)才能排放。现取该法处理后的废水100.0mL,用“试银灵”为指示剂、1.0×10-4mol/L的AgNO3标准溶液滴定,终点时溶液由黄色变为橙红色,消耗标准液的体积为5.00mL,反应的离子方程式为Ag + 2CN—=[Ag(CN)2]一,该水样中CN-的含量为________mg/L(不考虑Cr等元素的干扰)。该厂处理后的废水能否合法排放________。
-
(15分)【化学---化学与技术】
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
(1)上述处理废水流程中主要采用的方法是。
(2)流程②中,反应后无气体放出,该反应的离子方程式为________。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:________
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为:________。
(5)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因:________。
-
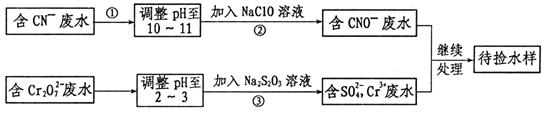
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
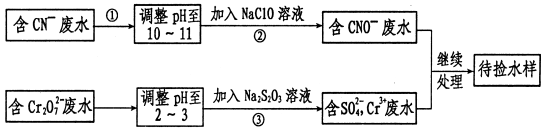
回答下列问题:
(1)上述处理废水流程中主要采用的方法是 。
(2)流程②中,反应后无气体放出,该反应的离子方程式为 。
(3)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为: 。
(4)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因:(用化学用语表示)
-
(14分)某工业废水中含有CN-和Cr2O72—等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
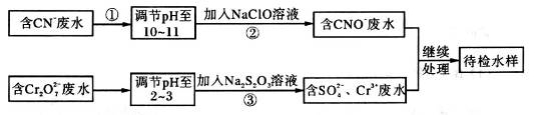
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32—+ Cr2O72—+H+ SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol·L—1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=_________________。若25ºC 时Ka=1×10-9 则同体积均为0.1mol·L-1的NaCN、HCN的混合溶液中下列说法不正确的是
a.此溶液一定有C(Na+)+C(H+)=C(OH‾)+C(CN‾)
b.混合溶液中水的电离程度一定大于该温度下纯水的电离程度。
c.此溶液一定有C(Na+)=C(HCN)+ C(CN‾)
d.此溶液加入少量氢氧化钠或盐酸溶液的PH值变化不大
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是____________。
-
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。
-
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
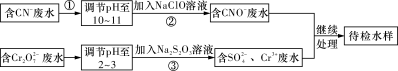
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:________________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移____________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_____________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:_________________。
-
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理,回答下列问题:
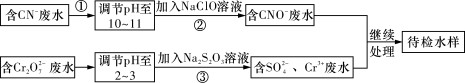
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:_________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每消耗0.4 mol Cr2O72-转移________mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a__________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是:___________________,___________________。
-
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
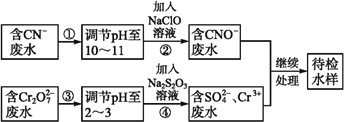
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______________。
(2)步骤④的反应为S2+Cr2O72-+H+ SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
SO42-+Cr3++H2O(未配平), 则每消耗0.4 molCr2O72-转移转移____mol e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是_________________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示HCN的电离常数Ka=____。若25 ℃时将浓度均为0.1 mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____(填字母)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)除去废水中的阳离子:取水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入一定量的Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式为_______、___________。
-
某工业废水含有CN-和Cr2O72-等离子,需经处理达标后才能排放,污水处理拟用下列流程进行处理:回答下列问题:
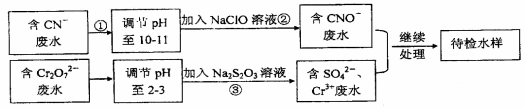
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______________。
(2)步骤③的反应方程式为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-,反应中S2O32-失去_______mo1 e-.
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________。
(4)在25℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,用含a的代数式表示CN-的水解常数Kh=_______mol·L-1。若25℃时将浓度均为0.1mol·L-1的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是___________ (填字母)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CN-)
b.此溶液一定有c(Na+)=c(HCN)+c(CN-)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
D.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
(5)利用Cr2O72-通过下列方法测定某锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnCl2中加入过量的FeCl3溶液,用b mol /L K2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m mL.则锡粉中锡的质量分数是___________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)

SO42—+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72—转移__________mol e-。