-
下列变化过程中,只破坏共价键的是( )
A.I2升华 B.NaF加热熔融
C.HCl溶于水得盐酸 D.蔗糖溶解
难度: 简单查看答案及解析
-
下列物质的电子式书写正确的是 ( )

难度: 简单查看答案及解析
-
已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )
难度: 简单查看答案及解析
-
NaHSO4在熔融态或者溶于水时都存在的离子是:( )
A. Na+ B.H+ C. HSO4- D. SO42-
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na与Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
难度: 简单查看答案及解析
-
下列表述正确的是( )
A.16O与18O互为同位素;H216O与H218O互为同素异形体
B.Cl-的结构示意图:
C.次氯酸分子的电子式为
D.12C、13C、14C三种原子是碳元素的三种核素
难度: 简单查看答案及解析
-
下列各组微粒具有相同的质子数和电子数的是( )
A.OH-、H2O、F- B.NH3、NH4+、NH2-
C.H3O+、NH4+、NH2- D.HCl、F2、H2S
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.由F原子形成1molF—F键要吸收热量
B.所有燃烧反应都要有氧气参与且都是放热反应
C.酸碱之间的中和反应都是放热反应
D.吸热反应必须加热才能进行
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C B.原子序数d>c>d>a
C.离子半径C>D>B>A D.单质的还原性A>B>D>C
难度: 简单查看答案及解析
-
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
A.B为第三周期的元素 B.C为VA族元素
C.三种元素都为非金属元素 D.C是化学性质最活泼的非金属元素
难度: 简单查看答案及解析
-
白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。根据图示的分子结构和有关数据计算1mol白磷完全燃烧放出的热量,其中正确的是( )

A.(6a+5d–4c–12b)kJ
B.(4c+12b–6a–5d)kJ
C.(4c+12b–4a–5d)kJ
D.(4a+5d–4c–12b)kJ
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1molNH2–含有10NA个电子
B.32gCH4中含有2NA个C–H键
C.5.3gNa2CO3溶于100mL水,溶液中Na +的浓度为0.1mol/L
D.1molNa2O2与足量H2O反应,转移电子数为2NA
难度: 简单查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是 ( )
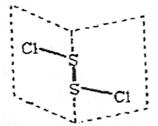
A.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
B.S2Cl2既含有极性键又含非极性键
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2> S2Cl2
D.S2Cl2的电子式为
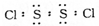
难度: 简单查看答案及解析
-
某种电池的总反应为 Fe+NiO2 + 2H2O
Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
A.放电时Fe是负极,NiO2是正极
B.放电时正极反应是:NiO2+H2O+2e-==。Ni(OH)2+2OH-
C.放电时,电解质溶液中阴离子向正极方向移动
D.该蓄电池的电极必须浸入某种碱性电解质溶液中
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
① H2O2分子中既含极性键又含非极性键
② 若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④周期表中共有18个列,其中形成化合物种类最多的元素在第14列
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥ 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦ 由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧ 原子序数为34号的元素属于长周期的副族元素
A.②⑤⑥⑧ B.①③④⑤ C.②④⑤⑦ D.③⑤⑦⑧
难度: 简单查看答案及解析
-
把下列物质分别加入装有水的锥形瓶里立即塞紧U形管的塞子,已知U形管内预先装有少量水(为使水容易观察,预先染成红色)。如图所示,结果U型管右边液面升高,则加入的物质可能是( )
①NaOH固体 ②浓H2SO4 ③NH4NO3晶体 ④Na2O2 ⑤生石灰
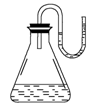
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
难度: 简单查看答案及解析
-
对下列各组离子的叙述正确的是( )
A.H+、ClO-、Ba2+、HCO3-能在水溶液中大量共存
B.Mg2+、NH4+、Fe2+、NO3-能在酸性溶液中大量共存
C.Fe3+、K+、SCN-、Cl-能大量共存且溶液显红色
D.Na+ 、NO3-、CO32-、SO32-能在碱性溶液中大量共存
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO32— = CO2↑+H2O
B.实验室用二氧化锰和浓盐酸制取Cl2:MnO2+4HCl (浓)=Mn2++ Cl 2↑+2H2O+ 2C1-
C.C12与NaOH溶液反应:Cl2+OH-=C1-+C1O-+H2O
D.实验室用硅酸钠溶液和稀盐酸制取硅酸胶体:2H++SiO32-=H2SiO3 (胶体)
难度: 简单查看答案及解析
-
下图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和。下列说法不正确的是( )
A.W元素形成的气态氢化物稳定性强于X的氢化物
B.Z与Y元素形成的化合物熔点很高
C.已知W单质分子间作用力较大,则其加压时易液化
D.Z的最高价氧化物能溶于X的最高价氧化物的水化物中
难度: 简单查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是( )
A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.放电时正极反应为: FeO42-+ 4H2O +3e- = Fe(OH)3+ 5OH-
C.放电时负极反应为:Zn—2e- +2OH- = Zn(OH)2
D.放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析
-
等温等压下,对于相同质量的H2、D2、T2气体,下列叙述正确的是( )
①密度之比为1:2:3 ②质子数之比为6:3:2 ③中子数之比为0:3:4 ④体积之比为6:3:2
A. ①②③④ B.②③④ C.①② D.③④
难度: 简单查看答案及解析
-
从周期表推测, 若存在116号元素,下列性质推断正确的是( )
A.其钠盐的化学式为Na2X
B.X是金属元素
C.其最高价氧化物的水化物为强酸
D.其最高价氧化物为XO3
难度: 简单查看答案及解析
-
分析如下残缺的反应:RO3-+________+6H+=3R2+3H2O。下列叙述正确的是( )
A.元素R位于周期表中第ⅤA族
B.在任何反应中RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol
难度: 简单查看答案及解析
-
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
A.已知Ce原子序数是58,则其为镧系元素
B.铈有四种稳定的核素
Ce、
Ce、
Ce、
Ce,它们互为同位素
C.用Ce(SO4)2溶液可与硫酸亚铁溶液反应,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
难度: 简单查看答案及解析
-
在两种短周期元素组成的化合物中,它们的原子个数比为1:2,设两种元素的原子序数分别为a和b,则下列对a和b可能的关系概括得最完全的是( )
①a+b=15 ②a=b+15 ③a=b-5 ④a+b=22
A. ①④ B. ①③④ C. ①②③④ D. ①②④
难度: 简单查看答案及解析