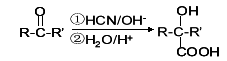-
中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是
A.火法炼铜
B.粘土制陶瓷
C.树皮造纸
D.打磨磁石制指南针




难度: 简单查看答案及解析
-
下列物质与用途对应关系不正确的是
选项
A
B
C
D
物质
单质碘
苯甲酸钠
聚乙烯
二氧化硅
用途
食盐添加剂
食品防腐剂
食品保鲜膜
光导纤维
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.热稳定性:H2O > H2S B.酸性:HCl > H2CO3
C.金属性:K > Li D.碱性:NaOH > Mg(OH)2
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A.S2- 的结构示意图:
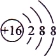
B.乙酸的结构简式: C2H4O2
C.中子数为20的氯原子:
D.二氧化碳分子的比例模型是:
难度: 简单查看答案及解析
-
已知反应 2SO2 (g) + O2 (g)
2SO3 (g) ∆H < 0,下列说法不正确的是
A.升高温度,正、逆反应速率均加快
B.增大压强,化学平衡正向移动
C.充入O2,可提高SO2的转化率
D.当气体总质量不变时,反应达平衡状态
难度: 简单查看答案及解析
-
下列解释事实的离子方程式正确的是
A.明矾做净水剂:Al3+ + 3H2O = Al (OH)3↓+ 3H+
B.小苏打治疗胃酸过多:CO32-+ 2H+ = CO2↑+ H2O
C.漂白液加白醋,提高漂白效率:CH3COOH + ClO-= HClO + CH3COO-
D.酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I- + O2 + 2H2O = 2I2 + 4OH-
难度: 简单查看答案及解析
-
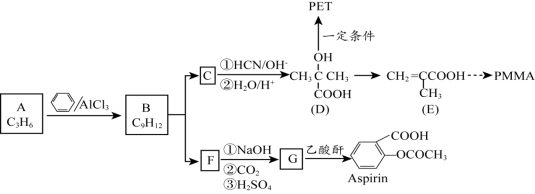
2015年10月,中国科学家屠呦呦因为创制了新型抗疟药——青蒿素,获得诺贝尔生理学或医学奖。青蒿素可由香茅醛为原料制取,下列说法不正确的是

A.香茅醛能使Br2的CCl4溶液褪色
B.青蒿素分子式为C15H22O5
C.青蒿素在一定条件下可发生水解反应
D.二者均可与氢气发生加成反应
难度: 简单查看答案及解析
-
若N A表示阿伏加德罗常数,下列说法正确的是
A.1 mol Na2O2固体中含离子总数为4 N A
B.标准状况下,22.4 L N2和H2混合气中含N A个原子
C.常温下,pH=13的NaOH溶液中OH-离子数目为0.1 N A
D.3H2 (g)+N2 (g)
2NH3 (g) ΔH=-92 kJ/mol,若反应放出9.2 kJ热量,则参加反应的氢分子数目为0.3 N A
难度: 简单查看答案及解析
-
2015年8月12日,天津港大爆炸造成巨量危险化学品NaCN(氰化钠)的部分泄露。泄露的NaCN可用双氧水处理,其化学反应方程式:NaCN + H2O2+ H2O = NaHCO3+ NH3,下列有关说法不正确的是
A.NaCN中碳元素化合价为+2价
B.NaCN中含有离子键和极性共价键
C.H2O2既做氧化剂又做还原剂
D.当有0.1 mol NH3生成时,有0.2 mol电子转移
难度: 简单查看答案及解析
-
常温下,1 mol化学键形成(或断裂)的能量变化用E表示。根据表中信息判断,下列说法正确的是
共价键
H — H
Cl — Cl
H — Cl
E (kJ · mol-1)
436
243
432
A.H2 (g) + Cl2 (g) = 2HCl (g)ΔH =+ 247 kJ · mol-1
B.H (g) + Cl (g) → HCl (g)ΔH =+432 kJ · mol-1
C.1 mol H2 (g) 与1 mol Cl2 (g)的总能量高于2 mol HCl (g) 的总能量
D.用电子式表示HCl的形成过程:
难度: 中等查看答案及解析
-
常温下,有关 0.1 mol/L NH4Cl 溶液(pH<7),下列说法不正确的是
A.根据以上信息,可推断NH3·H2O为弱电解质
B.加水稀释过程中,c(H+) · c(OH-) 的值增大
C.加入K2CO3固体可促进 NH4+ 的水解
D.同pH的NH4Cl溶液和CH3COOH溶液,由水电离出的c(H+) 前者大
难度: 简单查看答案及解析
-
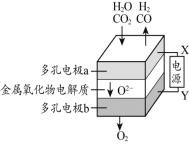
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入活性炭和NO,生成N2和气体X。当温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
活性炭
NO
N2
X
初始
2.030
0.100
0
0
T1
2.000
0.040
0.030
0.030
T2
2.005
0.050
0.025
0.025
判断下列说法正确的是
A.气体X的化学式为CO2
B.T1 ℃ 时的平衡常数K1 =
C.根据上述信息判断,T1> T2
D.T1 ℃ 时,向平衡体系中继续加入活性炭,可提高NO的转化率
难度: 简单查看答案及解析
-
下列关于各图像的解释或结论不正确的是
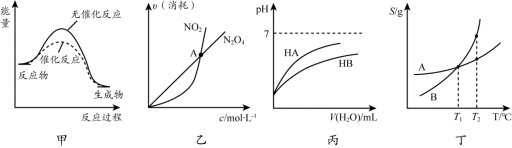
A.由甲可知:使用催化剂不影响反应热
B.由乙可知:对于恒温恒容条件下的反应2NO2 (g)
N2O4 (g),A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
难度: 简单查看答案及解析
-
下列能达到实验目的的是
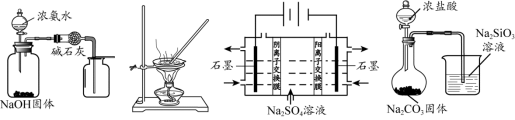
图1 图2 图3 图4
A.用图1所示装置制取并收集干燥纯净的NH3
B.用图2所示装置蒸发FeCl3溶液制备无水FeCl3
C.用图3所示装置制硫酸和氢氧化钠
D.用图4所示装置比较HCl、H2CO3 和H2SiO3 的酸性强弱
难度: 简单查看答案及解析