-
下列各组中的反应,属于同一反应类型的是( )
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
难度: 简单查看答案及解析
-
下列物质的结构与性质与氢键无关的是
①乙醚的沸点②冰的密度比液态水小③邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低④水分子在高温下很稳定⑤氢化镁的晶格能高⑥DNA的双螺旋结构⑦尿素的熔沸点比醋酸高
A. ④⑥② B. ①④⑤ C. ②⑤⑥ D. ③⑤⑦
难度: 困难查看答案及解析
-
化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是
(几种稀土元素的电离能(单位:KJ/mol))
元素
I1
I2
I3
I4
A.Se(钪)
633
1235
2389
7019
B.Y(铱)
616
1181
1980
5963
C.La(镧)
538
1067
1850
4819
D.Ce(铈)
527
1047
1949
3547
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列各选项所述的两个量,前者一定大于后者的是 ( )
①Al原子和N原子的未成对电子数 ②Ag+、Cu2+与NH3形成配合物时的配位数 ③H—F的键能与H—I的键能 ④F元素和O元素的电负性 ⑤N和O元素的第一电离能
A. ①④⑤ B. ②④ C. ②④⑤ D. ③④⑤
难度: 中等查看答案及解析
-
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是 ( )
A. C3N4晶体是分子晶体
B. C3N4晶体中C—N键的键长比金刚石中的C—C键的键长短
C. C3N4晶体中C、N原子个数之比为4∶3
D. C3N4晶体中微粒间通过离子键结合
难度: 简单查看答案及解析
-
闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是
A. 上述钛原子中,中子数不可能为22
B. 钛元素在周期表中处于第四周期
C. 钛的不同同位素在周期表中处于不同的位置
D. 钛元素是d区的过渡元素
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法正确的是
A. 碘是人体必需微量元素,所以要多吃富含碘的食物
B. 为使水果尽快成熟,需要用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯
C. 液态植物油中有碳碳双键,与氢气加成后可以形成人造脂肪,摄入过多对人体无害
D. 加热能杀死流感病毒是因为蛋白质受热变性
难度: 中等查看答案及解析
-
下列各组中的物质均能发生加成反应的是
A. 乙烯和乙醇 B. 苯和聚乙炔 C. 乙酸和溴乙烷 D. 丙炔和聚氯乙烯
难度: 简单查看答案及解析
-
下列说法错误的是
A. 某些金属在灼烧时会产生特殊的颜色,是由于电子跃迁时能量以光的形式释放出来
B. 1-36号元素中,原子最外层有3个未成对电子的元素有3个
C. 除ds区外,以最后填入电子的轨道能级符号作为区的名称
D. 气态电中性的原子失去1个电子转化为气态正离子所需要的最低能量称为第一电离能
难度: 中等查看答案及解析
-
目前科学家们已经合成许多硫-氮化合物,其中一种结构如图所示。关于该物质说法正确的是
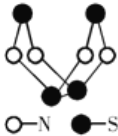
A. 该物质的分子式为SN
B. 该物质熔、沸点较低
C. 该物质分子中所有原子的最外层均达到稳定结构
D. 该物质与化合物S2N2互为同素异形体
难度: 中等查看答案及解析
-
有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
第一组
A -268.8
B -249.5
C -185.8
D -151.7
第二组
F2 -187.0
Cl2 -33.6
Br2 58.7
I2 184.0
第三组
HF 19.4
HCl -84.0
HBr -67.0
HI -35.3
第四组
H2O 100.0
H2S -60.2
H2Se -42.0
H2Te -1.8
下列各项判断正确的是
A. 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强
B. 第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se
C. 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI
D. 第一组物质是分子晶体,一定含有共价键
难度: 中等查看答案及解析
-
关于化合物
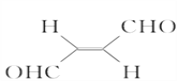 ,下列叙述正确的是( )
,下列叙述正确的是( )A. 分子间可形成氢键 B. 分子中既有极性键又有非极性键
C. 分子中有7个σ键和1个π键 D. 该分子在水中的溶解度小于2丁烯
难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA,下列结论错误的是 ( )
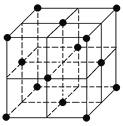
A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
难度: 中等查看答案及解析
-
下列化合物中含有2个手性碳原子的是
A.
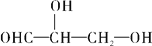
B.
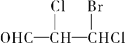
C.
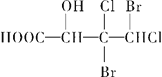
D.
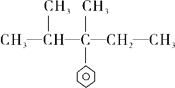
难度: 简单查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
下列有关说法不正确的是

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 金属铜中Cu原子堆积模型如图4为最密堆积每个Cu原子的配位数均为12
难度: 中等查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述1
表述2
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比PbH4分子稳定性高
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小
C
在形成化合物时,同一主族元素的化合价相同
同一主族元素原子的最外层电子数相同
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法错误的是
A. 在NH
和[Cu(NH3)4]2+中都存在配位键
B.
σ键和π键比例为7:1
C. C
与O
互为等电子体,1 mol O
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
难度: 困难查看答案及解析
-
通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为:
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
难度: 中等查看答案及解析
-
以下说法不正确的是( )
A. 1mol乙醇可以与足量金属钠反应,生成0.5molH2,能证明乙醇分子有一个H原子与其余的H原子不同
B. 下列反应可证明苯环受甲基的影响,甲苯易被酸性高锰酸钾氧化
C. 下列反应可证明由于羟基对苯环的影响,导致苯酚的取代比苯容易
D. 苯不能使溴的四氯化碳溶液褪色可以说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 困难查看答案及解析
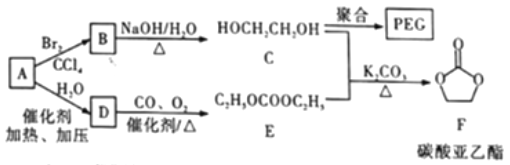



 。
。