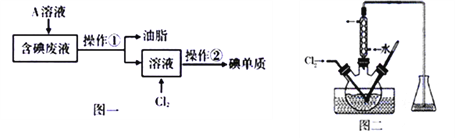
-
十九大报告指出:建设生态文明是中华民族永续发展的千年大计。必须树立和践行绿水青山就是金山银山的理念.....,实行最严格的生态环境保护制度,形成绿色发展方式和生活方式。则下列说法不正确的是
A. PM2.5是指粒径不大于2.5µm的可吸入悬浮颗粒物
B. 以液化石油气代替燃油可减少大气污染
C. 生活污水可灌溉庄稼,所以能排放到自然界水体中
D. 创新生产工艺,实现电动机车替代燃油机车符合绿色发展方式
难度: 中等查看答案及解析
-
下列说法正确的是
A. 可以用酸性高锰酸钾溶液除去甲烷中的乙烯
B. 分子式为C8H10的芳香烃共有4 种
C. C3H6Br2有5种结构
D. 某卤代烃中加入氢氧化钠溶液,加热,静置后,在上层清液中加硝酸银溶液,若出现浅黄色沉淀,则证明该卤代烃中含有溴原子
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数逐渐增大,其中X原子的电子数与电子层数相等,Z为短周期中金属性最强的元素,Y与X、Y与Z均能形成原子个数比为1∶1和1∶2的两种化合物,Y和W同主族。下列说法正确的是( )
A. Y与Z形成的两种化合物中阴阳离子个数比均为1:2
B. X与其他三种元素形成的二元化合物中其化合价均为+1
C. Y、Z、W三种元素形成的化合物的水溶液一定呈中性
D. X、Y、Z、W形成的简单离子的半径依次增大
难度: 中等查看答案及解析
-
根据下列实验操作和现象得出的结论正确的是
选项
实验
现象
结论
A
向氯化铝溶液中,加入过量氨水
产生白色沉淀
氢氧化铝不溶于碱
B
将盐酸与石灰石反应产生的气体通入硅酸钠溶液
硅酸钠溶液变浑浊
证明非金属性:Cl>C>Si
C
向淀粉溶液中滴入硫酸,加热一段时间后,滴入银氨溶液,水浴加热
无银镜现象出现。
淀粉未水解
D
溶有SO2的BaCl2溶液中通入气体X
有白色沉淀生成
X可能是Cl2或NH3等
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2g D218O中所含中子数为NA
B. 2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
C. 1mol/L碳酸氢钠溶液中的HCO3—数目小于NA
D. 一定条件下,39g的乙炔和苯的气体混合物中所含原子总数为6NA
难度: 中等查看答案及解析
-
以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
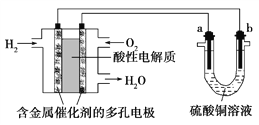
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 中等查看答案及解析
-
常温下,取0.1mol/L的NaA和NaB 两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
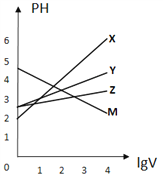
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH: NaA 溶液>NaB 溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L 的NaA和HA 的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
难度: 中等查看答案及解析
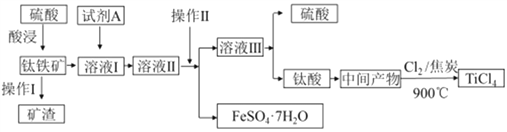
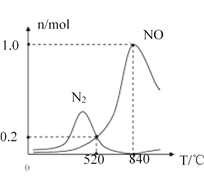
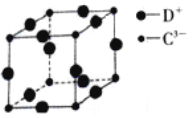
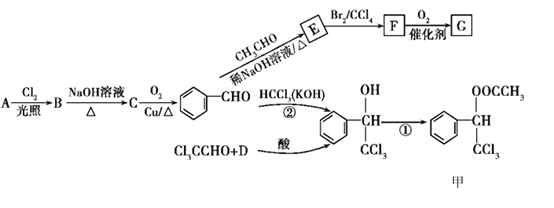
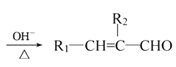 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)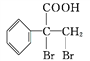 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以