-
A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素单质的电子式为________;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质的晶体类型属于________________;基态D原子共有__________种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是__________,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是_______(填化学式),此配离子中的两种配体的不同之处为_____________(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为________;写出与BC-互为等电子体的分子和离子各一种________、_________(填化学式)。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是___________________________。
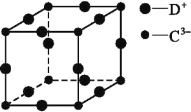
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为________,晶体的密度为_____ g·cm-3。
-
A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A 元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原 因是______。
(5)D3C 具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

-
A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A 元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原 因是______。
(5)D3C 具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

-
A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A 元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原 因是______。
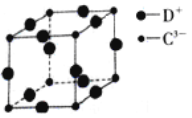
(5)D3C 具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。
-
A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A 元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原 因是______。
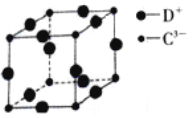
(5)D3C 具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。
-
X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增。已知X的最外层电子数是次外层电子数的3倍,X、M同主族,Y在同周期主族元素中原子半径最大,Z的最高化合价与最低化合价的代数和为零。下列说法正确的是
A. 单质的氧化性:X<M
B. 气态氢化物的热稳定性:M>N
C. X与Y简单离子半径:r(X离子)<r(Y离子)
D. 化合物ZX2与ZN4含有相同类型的化学键
-
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因。请回答下列问题:
(1)七种元素中,非金属性最强的元素在周期表中的位置是 。
(2)由C、D形成的一种淡黄色固体的电子式 。画出G离子的结构示意图 。
(3)G元素的单质有毒,可用D的最高价氧化物对应的水化物的溶液吸收,其离子方程式为 。
(4)将两份足量的E单质分别加入到等体积等浓度的硫酸和NaOH溶液中,充分反应生成的气体的体积比为 。
(5)由A、B、C所形成的常见离子化合物是 (写化学式),该化合物与D的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为 。
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
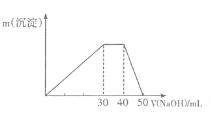
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀经过滤、洗涤、干燥后,称得质量为4.66g
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,得到的沉淀和滴加的氢氧化钠溶液体积的关系如图,该白色晶体的组成(用化学式表示)为 。
-
〔化学—选修3:物质结构与性质〕(15分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32 -离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
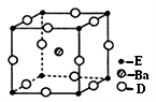
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为 。
纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
-
W、X、Y、Z均为元素周期表中短周期主族元素,且原子序数依次增大,X+的电子层结构与He相同,Y原子核外K层和L层电子数之比为1:3,元素Z的最高化合价与最低化合价代数和为6。下列叙述正确的是
A. Y、Z两种元素位于同一周期
B. 最外层电子数:Z>Y>X>W
C. 离子半径:Z->Y2->X+
D. W与Y形成的A2B2型化合物,既含离子键又含共价键
-
现有七种短周期主族元素,其原子序数按A、B、C、D、E、F、G的顺序递增。A元素的最高正化合价和最低负化合价的代数和等于0,且A是形成化合物种类最多的元素;C原子能形成分别含10电子、18电子的两种阴离子,且C与F位于同一主族;D单质投入冷水中反应缓慢,投入沸水中迅速产生气泡;E的简单阳离子是同周期元素所形成的简单离子中半径最小的。回答下列问题:
(1)B位于周期表第________周期第________族。
(2)A、B、C三种元素能形成等电子体,请写出其中一组等电子体:________________________________________________________________________。
(3)元素M位于E与F元素之间,且M单质是优良的半导体材料,广泛用于太阳能电池。M、F、G的气态氢化物的稳定性由强到弱的顺序为______________(用化学式表示)。
(4)若选择三种试剂设计实验能证明非金属性:B>A>M,用化学方程式表示实验原理:__________________________________________________。
(5)A、M、F、G的最高价氧化物对应水化物的酸性由强到弱的顺序为________________________(用化学式表示)。
(6)下列实验方法能证明D与E的金属性强弱关系的是________(填字母序号)。
A.比较D和E的单质分别与稀硫酸反应产生气泡的快慢
B.比较D和E的单质分别与同浓度的氢氧化钠溶液反应产生气泡的快慢
C.比较D和E的单质分别与氯气、氧气、硫等非金属单质反应的产物






