-
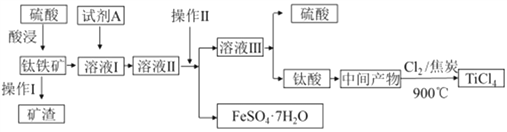
金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O 胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)  TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)  TiCl4(g)+O2(g) △ H=+ 151kJ/mol
TiCl4(g)+O2(g) △ H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
方法二: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
-
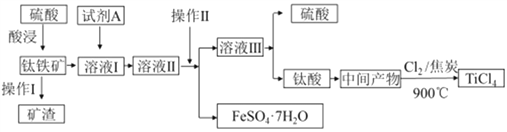
金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O 胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)  TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g)  TiCl4(g)+O2(g) △ H=+ 151kJ/mol
TiCl4(g)+O2(g) △ H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
方法二: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
-
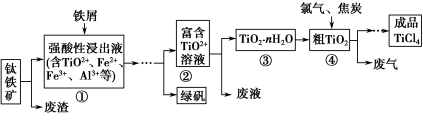
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
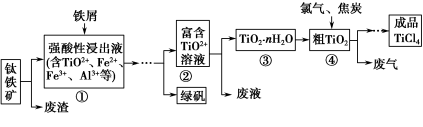
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
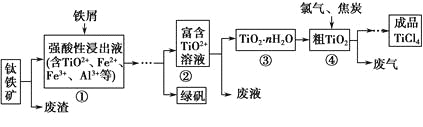
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是________.
(2)在②→③工艺中需要控制条件以形成TiO2•nH2O溶胶,该分散质颗粒直径大小在________范围.
(3)若把③中制得的固体TiO2•nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+⇌Fe3++H2O的平衡常数K=________.
(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项).
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法.
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
四氯化钛(TiCl4)是制取航天航空工业材料--钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
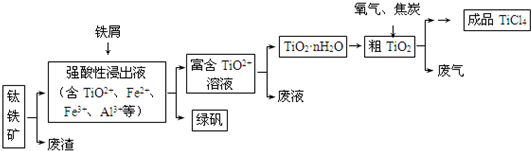
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生.
2Fe3++Fe═3Fe2+
2TiO2+(无色)+Fe+4H+═2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O═TiO2+(无色)+Fe2++2H+
加入铁屑的作用是________.
(2)在②→③工艺中需要控制条件以形成TiO2•nH2O溶胶,该分散质颗粒直径大小在________范围.
(3)若把③中制得的固体TiO2•nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+⇌Fe3++H2O的平衡常数K=________.
(4)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项).
(6)依据如表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法.
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
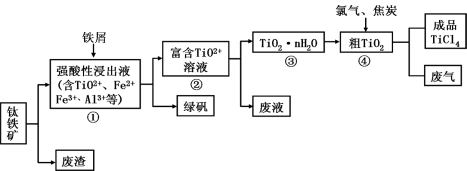
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ==== 3Fe2+
2 TiO2+(无色)+ Fe + 4H+==== 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ==== TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在
范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25°C时,Ksp[Fe(OH)3] =2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)====TiCl 4(l)+O2(g) ΔH=+140kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221kJ·mol-1
2CO(g) △H=-221kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl 4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(6)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用 方法。
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ==== 3Fe2+ 2TiO2+(无色)+ Fe + 4H+==== 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ==== TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在_________范围。
(3)写出④中TiO2和焦炭、氯气反应的化学方程式:______________________________。
(4)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(5)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用 方法。
| TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
-
工业由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:
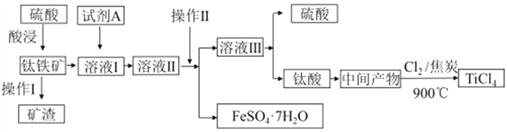
请答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中钛元素的化合价为_____。
(2)试剂A为____,加入A的目的是____ (填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
“溶液II经“操作II"可得副产品FeSO4·7H2O,则“操作II”包括浓缩、冷却、_____。
(3)若“溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过__。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s)  TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
TiO2(s)+H2O(g),上述工艺流程中生成TiCl4化学方程式为_____________________。
已知TiO2(s)+2Cl2(g)=TiC14(l)+O2(g) △H=+151kJ/mol,该反应极难进行,当向反应体系中加入焦炭后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是_______。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学方程式是_______。

TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiCl4(g)+O2(g) △ H=+ 151kJ/mol
2MgCl2+Ti








