-
硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等.
(1)工业制硫酸铜的方法很多.
①方法一、用浓硫酸和铜制取硫酸铜.该反应的化学方程式是________,此法的最大缺点是________.
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如图所示:
稀硫酸、铜和氧化铁反应的化学方程式是________;向混合溶液中通入热空气的反应的离子方程式是________;由滤液得到无水硫酸铜的实验操作是________.
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵.主要的工艺流程如图所示:
①吸收塔中发生反应的化学方程式是________.
②有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高.当控制一定流量的尾气时,调节溶液的pH的方法是________.难度: 中等查看答案及解析
-
工业上用硫碘开路循环联产氢气和硫酸的工艺流程如图所示:

请回答下列问题:
(1)在反应器中发生反应的化学方程式是________.
(2)在膜反应器中发生反应:2HI(g)⇌H2(g)+I2(g)△H>0.若在一定条件密闭容器中加入1mol HI(g),n(H2)随时间(t)的变化关系如图1所示:
①该温度下,反应平衡常数K=________,若升高温度,K值将________(填“增大”、“减小”或“不变”).
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是________.
(3)电渗析装置如图2所示:
①结合电极反应式解释阴极区HIx转化为HI的原理是________.
②该装置中发生的总反应的化学方程式是________.
(4)上述工艺流程中循环利用的物质是________.难度: 中等查看答案及解析
-
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物.
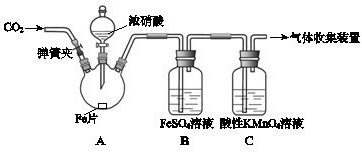
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
请回答下列问题:实验操作 实验现象 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. 无明显现象. 加热烧瓶,反应开始后停止加热. ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅.
②反应停止后,A中无固体剩余.
(1)滴入浓硝酸加热前没有明显现象的原因是________.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是________.
(3)甲取少量B中溶液,加热,实验现象是________.请用化学平衡原理解释原因:________.甲依据该现象得出的结论是A中有NO生成.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是________,证明有NO生成的实验现象是________.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)________.
a.铁粉 b.溴水 c.鉄氰化钾溶液 d.硫氰化钾溶液.难度: 中等查看答案及解析
-
重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如图所示:

已知:iii N的结构简式是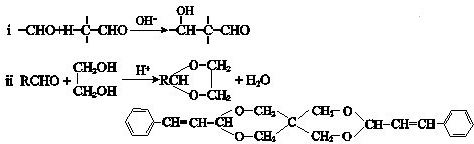
请回答下列问题:
(1)A中含氧官能团名称是________;由A生成B的反应类型是________.
(2)X的结构简式是________.
(3)C和甲醇反应的产物可以聚合形成有机玻璃.该聚合反应的化学方程式是________.
(4)E的结构简式是________.
(5)下列说法正确的是________.
a.E能发生消去反应
b.1molM中含有4mol酯基
c.X与Y是同系物
d.G不存在顺反异构体
(6)由Y生成D的化学方程式是________.
(7)Z的结构简式是________.难度: 中等查看答案及解析