-
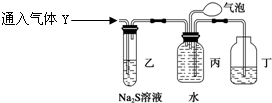
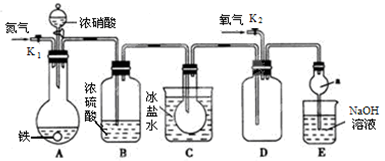
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
文献记载:Ⅰ.在浓硝酸与活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.FeSO4+NO Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是________ 。
(3)甲取少量B中溶液,加热,实验现象是 。请用化学平衡原理解释原因: 。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是 ,证明有NO生成的实验现象是 。
(5)证明A溶液中含有Fe3+,选择的药品是(填序号) 。
A.铁粉 B.溴水 C.铁氰化钾溶液 D.硫氰化钾溶液
-
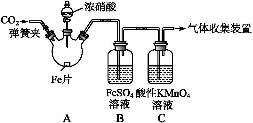
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是____________________________。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是__________。
(3)甲取少量B中溶液,加热,实验现象是_________________________。请用化学平衡原理解释原因:_________________________。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是___________________________________,证明有NO生成的实验现象是___________________________________。
(5)证明A溶液中含有Fe3+,选择的药品是(填序号)________。
A.铁粉 B.溴水
C.铁氰化钾溶液 D.硫氰化钾溶液
-
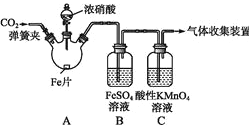
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物.
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
II.FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0.
III.NO2和NO都能被KMnO4氧化吸收.
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅.
②反应停止后,A中无固体剩余. |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是________.
(2)检验是否生成-3价氮的化合物,应进行的实验操作是________.
(3)甲取少量B中溶液,加热,实验现象是________.请用化学平衡原理解释原因:________.甲依据该现象得出的结论是A中有NO生成.
(4)乙认为甲得出A中有NO生成的证据不足.为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是________,证明有NO生成的实验现象是________.
(5)证明A溶液中是否含有Fe2+和Fe3+,选择的药品是(填序号)________.
a.铁粉 b.溴水 c.鉄氰化钾溶液 d.硫氰化钾溶液.
-
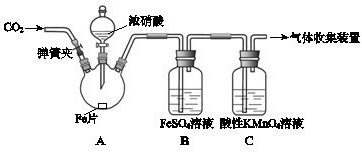
(16分)某化学兴趣小组用下图所示装置进行实验,探究硝酸与铁反应的产物。
查阅资料得知:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
请回答下列问题:
(1)装置中各仪器装入试剂后,接下来由先至后的操作顺序为 。
A.通入N2 B.滴入浓HNO3 C.打开活塞K1 D.关闭活塞K1
(2)装置A中,滴入浓硝酸加热前没有明显现象的原因是 。
(3)反应结束后,打开装置D中的活塞K2,并通入氧气,铁完全溶解于浓硝酸后生成的NO2气体中含有NO的现象为 。
装置D中发生的反应的化学方程式为 。
(4)C装置的作用是 。
(5)反应停止后,装置A中无固体剩余。证明装置A的溶液中是否含有Fe2+,选择的药品是 (填序号)。
a.铁粉 b.氯水 c.KMnO4溶液 d.硫氰化钾溶液
(6)检验是否生成﹣3价氮的化合物,应进行的实验操作、现象及结论是 。
-
较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用下列仪器组装装置来直接验证有NO、NO2生成并制取氮化镁。(假设实验中每步转化均是完全的)

已知:①NO2沸点是21.1℃、熔点是-11℃;NO的沸点是-151℃、熔点是-164℃;②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是(_____) (填序号)。
a. A→ D → C → F → B → F →E b. A→ C → D → F → B → F →E
c. A→ F → C → D → F → B →E d. A→ F → D → C → F → B →E
(2)确定还原产物中有NO2的现象是______________________________,实验中两次使用装置F,第二次使用装置F的作用是____________________________________。
(3)实验前需先打开开关K,向装置内通CO2气体,其目的是____________,当_______________时停止通入CO2。
(4)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式____________________________________________________。
(5)在A中反应开始时,某同学马上点燃B处的酒精灯,实验结束后通过测定发现B处的产品纯度不高,原因是______________________________________(用化学方程式回答)。
(6)验证B处有氮化镁生成的方法是_______________。
-
已知硝酸与金属发生反应时,随着硝酸浓度的下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是 、NO、
、NO、 、
、 或
或 中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入
中的一种或几种。某同学取一定量的铝铁合金与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入 溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
溶液,所加NaOH溶液的体积与产生沉淀的物质的量的关系如图所示。试回答下列问题:
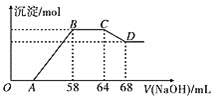
 写出合金中铁与该稀硝酸反应的离子方程式:___________。
写出合金中铁与该稀硝酸反应的离子方程式:___________。
 合金中铝的物质的量为__________mol,铁的物质的量为__________mol。
合金中铝的物质的量为__________mol,铁的物质的量为__________mol。
 点对应的沉淀的物质的量为__________mol。
点对应的沉淀的物质的量为__________mol。
 点对应的氢氧化钠溶液的体积为__________mL。
点对应的氢氧化钠溶液的体积为__________mL。
-
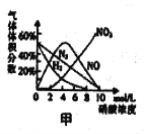
硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
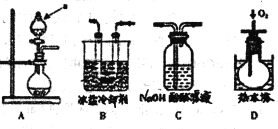
(1)后一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(2)从第一个C装置中逸出的气体成分是________。
(3)溶液中还可能有一种还原产物,这种还原产物可能是_____,请设计实验验证你的猜想________;并写出生成该还原产物的化学方程式_____________
-
(15分) 某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因
_______________________________________________________________________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1 mol·L-1 KSCN溶液;0.1 mol·L-1 KI溶液;0.2 mol·L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+。 | |
探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
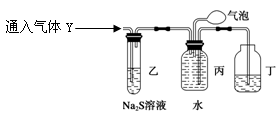
(3)装置乙的作用:。
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定
气体Y中含NO? 说明理由。
________________________________________________________________________。
(5) 同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15 mol·L-1酸性KMnO4溶液滴定,消耗20 mLKMnO4溶液。
则气体Y中NO、NO2的体积比为________。
(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
-
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因①_____________②_____________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,甲同学设计如下实验:
有药品和仪器:0.1mol/L KSCN溶液、0.1mol/L KI溶液、0.2mol/L酸性高锰酸钾溶液、氯水等,试管和滴管。
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2~3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe3+。 | |
探究二
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
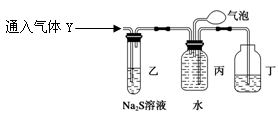
(3)装置乙的作用: ________。
(4)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由____________。
(5)同学丁为了探究气体Y的组成,在标准状况下将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.1500mol/L酸性KMnO4溶液滴定,消耗20.00mLKMnO4溶液。则气体Y中NO、NO2的体积比为 ________ 。(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
-
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因______.
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol•L-1 KSCN溶液;0.1mol•L-1 KI溶液;0.2mol•L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | ______ | ______ |
| 第二步 | ______ | 若溶液紫色褪去,则溶液含有Fe2+;
若无明显变化,则不含Fe3+. | ______ |
探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
(3)装置乙的作用:______.
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由.______.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol•L-1酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为______.(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)