-
关于
说法错误的是
A. 质子数为7 B. 中子数为7
C. 质量数为14 D. 相对原子质量为14
难度: 简单查看答案及解析
-
含有极性共价键的电解质是
A. CaCl2 B. H2O C. NH3 D. CH4
难度: 简单查看答案及解析
-
电解饱和食盐水的阳极产物是
A. NaOH B. H2 C. HCl D. Cl2
难度: 简单查看答案及解析
-
丙烷和丁烷是液化石油气的主要成分,它们互为
A. 同系物 B. 同素异形体 C. 同分异构体 D. 同位素
难度: 简单查看答案及解析
-
不能鉴别Fe2+和Fe3+的是
A. 氯水 B. 盐酸 C. 氢氧化钠溶液 D. 硫氰化钾溶液
难度: 简单查看答案及解析
-
钾、钠两种单质的化学性质相似,理由是
A. 同一主族元素 B. 化学键相同
C. 都是金属元素 D. 化合价相同
难度: 简单查看答案及解析
-
碳化硅(SiC)常用于电炉的耐火材料。关于SiC说法正确的是
A. 易挥发 B. 能导电
C. 熔化时破坏共价键 D. 属于分子晶体
难度: 简单查看答案及解析
-
接触法制硫酸中,通常不采取的措施是
A. 硫铁矿粉碎 B. 接触室中通入过量空气
C. 接触室控制温度约450 ℃ D. 使用高压
难度: 简单查看答案及解析
-
用酒精和浓硫酸为原料制取纯净的乙烯。下列使用的装置和试剂均正确的是

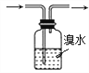
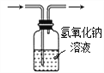

A. B. C. D.
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定条件下,下列物质与Cl2反应不能生成HCl的是
A. 甲烷 B. 乙烯 C. 苯 D. 水
难度: 中等查看答案及解析
-
关于硝酸铵说法正确的是
A. 属于共价化合物 B. 溶于水放热 C. 受热易分解 D. 属于有机氮肥
难度: 简单查看答案及解析
-
不能通过置换反应制取的是
A. Fe(OH)3 B. Fe3O4 C. Al(OH)3 D. Al2O3
难度: 中等查看答案及解析
-
海水提溴一般需要经过浓缩、氧化和提取三个步骤。下列对操作步骤描述错误的是
A. 浓缩的原理是蒸发结晶 B. 氧化时通入氯气
C. 提取时利用Br2易挥发 D. 提取时用CCl4萃取
难度: 中等查看答案及解析
-
FeCl3溶液吸收H2S的原理:2Fe3++H2S→2Fe2++2H++S↓。下列说法正确的是
A. H2S作氧化剂 B. 还原性:H2S > Fe2+
C. Fe3+ 发生氧化反应 D. 每消耗1mol H2S时转移4NA个电子
难度: 中等查看答案及解析
-
探究氢氧化铝的两性,最适宜的试剂是
A. Al、NaOH溶液、稀盐酸 B. Al2O3、氨水、稀盐酸
C. Al2(SO4)3溶液、NaOH溶液、稀盐酸 D. AlCl3溶液、氨水、稀盐酸
难度: 中等查看答案及解析
-
浓硫酸与蔗糖反应的实验,对现象的解释不合理的是
选项
现象
解释
A
蔗糖变黑
浓硫酸具有脱水性
B
有刺激性气味
浓硫酸具有强酸性
C
固体体积膨胀
生成大量气体
D
烧杯壁发烫
反应放热
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
室温时,0.1 mol/L某酸HA溶液的pH=3。关于该溶液叙述正确的是
A. 溶质的电离方程式为HA→H+ + A- B. 升高温度,溶液的pH增大
C. 若加入少量NaA固体,则c(A-)降低 D. 该溶液稀释10倍后,pH < 4
难度: 中等查看答案及解析
-
“双吸剂”含铁粉、活性炭和氯化钠等,可延长食品保质期。其作用原理正确的是
A. 主要发生吸氧腐蚀 B. 氯化钠充当正极
C. 吸收的气体是O2和CO2 D. 负极反应为Fe-3e→Fe3+
难度: 简单查看答案及解析
-
pH=13的溶液中,可能存在Na+、Ba2+、Fe3+、NH4+、Cl-、CO32-、SO42-,若Ba2+浓度为0.04 mol/L,则溶液中一定还大量存在的是
A. Na+ B. NH4+ C. Cl- D. SO42-
难度: 中等查看答案及解析
-
恒容密闭容器中发生反应:SiO2(s)+4HF(g)
SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
A. 反应物的总能量高于生成物的总能量
B. 若生成2mol液态水,则放出的热量大于148.9 kJ
C. 当v正(HF)=2v逆(H2O)时,反应达到平衡状态
D. 平衡后放出的热量随加入SiO2量的增加而增大
难度: 中等查看答案及解析
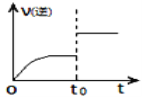
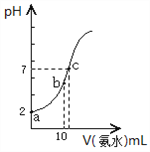


 Y……
Y……