-
化学与人类的生活息息相关,下列有关说法正确的是
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
难度: 简单查看答案及解析
-
NA表示阿伏伽德罗常数的值,下列有关叙述正确的个数为
①1mol苯乙烯中含有的碳碳双键数为4NA ②4.2g乙烯和丙烯混合气中含有的极性键数目为0.6NA ③标况下,3.36LHF含有的电子数为1.5NA ④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同 ⑤高温下,16.8gFe与足量水蒸气完全反应失去0.8NA个电子 ⑥在KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应中,每生成1molCl2转移的电子总数为2NA
⑦1mol铁粉在1mol氯气中充分燃烧,转移的电子数为2NA
A. 2个 B. 3个 C. 4个 D. 5个
难度: 简单查看答案及解析
-
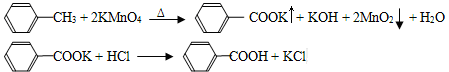
下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.属于酯类的有4种 B.属于羧酸类的有2种
C.既含有羟基又含有醛基的有3种 D.存在分子中含有六元环的同分异构体
难度: 简单查看答案及解析
-
下列根据实验操作和实验现象所得出的结论,正确的是
A
向2ml2%的CuSO4溶液中加入0.5ml 1%的NaOH溶液,振荡后滴加几滴M溶液,加热
未出现砖红色沉淀
M中不含醛基
B
在CuSO4溶液中加入KI溶液,再加入苯,振荡后静置
有白色沉淀生成,苯层呈紫红色
白色沉淀可能为CuI
C
向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液
出现褐色沉淀
N不是卤代烃
D
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液
溶液变为血红色
Fe(NO3)2样品已氧化变质
难度: 中等查看答案及解析
-
(周考3滚动)氨是生产氨肥、尿素等物质的重要原料。电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法不正确的是

A.图中所示物质中,X为N,Y为H2,Z为NH3
B.Y参与的电极反应为H2+2e—=2H+
C.当有3g H+通过质子交换膜时,Z的体积为22.4L(标况)
D.反应过程中左边区域溶液pH逐渐降低
难度: 简单查看答案及解析
-
剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25°C)
Ka=l. 77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7
Ka2=5. 6×10-11
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断正确的是
A. 离子半径由小到大的顺序:r (B) <r (C) <r(E) <r(D)
B. 元素C、D、E分别与B可以形成两种或者两种以上的氧化物
C. 元素D的最高价氧化物对应水化物的酸性比E的强
D. 元素B分别与A、C形成的化合物中化学键的类型完全相问同
难度: 简单查看答案及解析