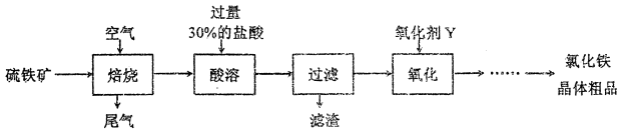
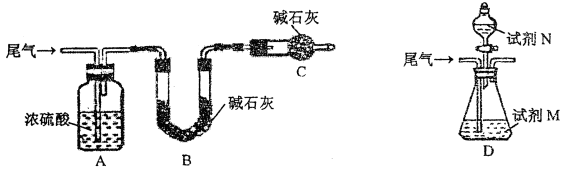
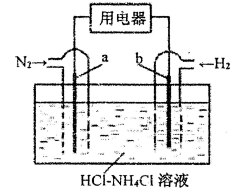
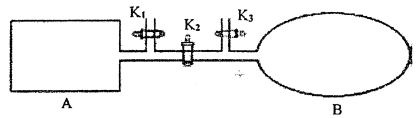-
化学与人类生产、生活密切相关,下列有关说法正确的是
A.喝不含杂质的纯净水比喝矿泉水对人体更营养、更健康
B.维生素C具有较强还原性,熟吃新鲜蔬菜维生素C损失小
C.波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害
D.亚硝酸钠具有强还原性而使肉类长时间保持鲜红,可在肉制食品中宜多加
难度: 简单查看答案及解析
-
下列实验过程中的现象及结论均正确且存在因果关系的是
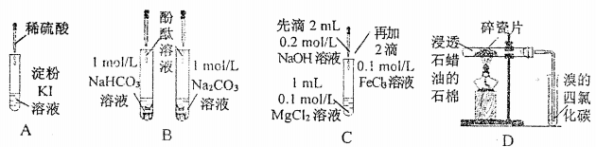
实验
实验现象
结论
A
无色溶液变蓝
I-在酸性条件下被氧气氧化为I2
B
溶液均呈红色,且深浅一样
相同浓度的CO32-与HCO3-水解能力相同
C
产生白色沉淀又逐渐变成红褐色沉淀
Ksp[Mg(OH)2] > Ksp[Fe(OH)3]
D
溴的四氯化碳溶液颜色褪去
石蜡催化加热反应产物为乙烯
难度: 困难查看答案及解析
-
下列有关乙烯气体和乙醇蒸气的说法正确的是
A.二者等物质的量完全燃烧消耗等量的氧气
B.二者分子所有原子都处于同一个平面上
C.二者能相互转化且反应属于可逆反应
D.二者可用酸性高锰酸钾溶液鉴别
难度: 中等查看答案及解析
-
常温下,下列有关说法正确的是
A.0.1 mol/L的Na2S溶液:c(OH-)=c(H+)十c(HS-)十c(H2S)
B.pH=11的氨水与pH=3的硫酸各1L混合后,c(NH4+)>2c(SO42-)
C.pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等
D.pH相同的①
 溶液②CH3COONa溶液中的c(Na+):①>②
溶液②CH3COONa溶液中的c(Na+):①>②难度: 困难查看答案及解析
-
甲、乙、丙、丁分别由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的化合物,可以发生如下图转化:
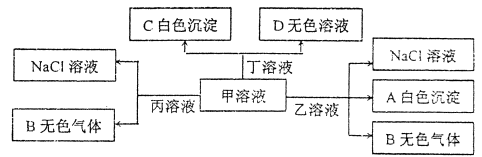
下列说法错误的是
A.乙为AlC13
B.能大量共存于溶液丙中的离子:Fe3+、SO42-、NO3-
C.甲溶液中粒子的等量关系:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.甲溶液中滴加少量丁溶液反应的离子方程式:HCO3-+ Ba2++OH-= BaCO3↓+H2O
难度: 困难查看答案及解析
-
在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g)
2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是
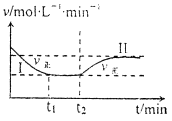
A.I、II两过程达到平衡时,平衡常数:KI<KII
B.I、II两过程达到平衡时,NH3的体积分数:I<II
C.I、II两过程达到平衡的标志:气体密度不再发生变化
D.t2时刻改变的条件可以是向密闭容器中加H2和N2混合气
难度: 困难查看答案及解析

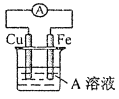

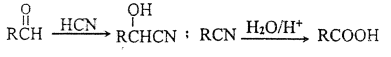
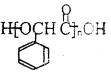 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂。
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂。