-
下列实验操作和数据记录都正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2 g
B.用50mL酸式滴定管量取KOH溶液,体积为36.60 mL
C.用湿润的pH试纸测稀盐酸溶液的pH,pH=3.52
D.用10mL量筒粗略量取NaCl溶液,体积为9.2 mL
难度: 简单查看答案及解析
-
下列说法中正确的是
A.实验室配制硫酸铁溶液时,加入稀硫酸主要是为了抑制硫酸铁水解
B.可以通过溶液间的反应制得Al2S3
C.泡沫灭火器原理为硫酸铝溶液和小苏打溶液反应,通常将硫酸铝溶液储存在铁罐中
D.加热蒸干氯化铁溶液可得到氯化铁晶体
难度: 简单查看答案及解析
-
下列关于能量判据和熵判据的说法中,不正确的是
A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B.由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程
C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行
D.放热过程(ΔH<0)或熵增加 (ΔS>0)的过程一定是自发的
难度: 简单查看答案及解析
-
下列离子方程式中,属于水解反应的是
A. HCOOH+H2O
HCOO-+H3O+ B. CO2+H2O
HCO3-+H+
C. CO32-+H2O
HCO3- +OH- D. HS-+H2O
S2-+H3O+
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中发生可逆反应: mA(g) + nB(g)
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是
A、体系的压强不再改变
B、混合气体的密度不再改变
C、混合气体的平均相对分子质量不再改变
D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应
难度: 简单查看答案及解析
-
下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) ΔH >0,下列图象中正确的是

难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g)
Z(g)+W(s) △H>0下列叙述正确的是
A、加入少量W,逆反应速度增大
B、当容器中气体压强不变时,反应达到平衡
C、升高温度,平衡逆向移动
D、平衡后加入X,上述热化学方程式中的△H增大
难度: 简单查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
难度: 简单查看答案及解析
-
25℃,水的电离达到平衡:H2O
H++OH- ,下列叙述正确的是
A.向水中加入稀醋酸,平衡逆向移动,c(H+)降低
B.向水中加入少量固体碳酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡正向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 简单查看答案及解析
-
25 ℃ 时,下列各溶液中关系的叙述中,正确的是:
A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
B.pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2∶1
C.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-) = 0.1 mol/L, 则BA(盐)溶液pH<7
D.4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ (注:酸性 C6H5OH 弱于 H2CO3)
难度: 简单查看答案及解析
-
根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2OZ(OH)2+H2↑
(3)Z2+的氧化性比X2+ 弱
(4)由Y、W作电极组成的原电池某电极反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是
A.X>Y>Z>W B.Y>X>W>Z
C.Z>X>Y>W D.Z>Y>X>W
难度: 简单查看答案及解析
-
下列物质中容易导电的强电解质是
A. 氯化钠晶体 B. 无水乙醇 C. 熔融硝酸钾 D. 水银
难度: 简单查看答案及解析
-
用食用白醋(醋酸浓度约1 mol•L-1)进行下列实验,能证明醋酸为弱电解质的是
A. 白醋中滴入石蕊试液呈红色 B. 白醋加入豆浆中有沉淀产生
C. 蛋壳浸泡在白醋中有气体放出 D. pH试纸显示白醋的pH为2~3
难度: 简单查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A. 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Al3+
D. 能与铝反应产生H2的溶液:K+、Ba2+、NO3-、Al3+
难度: 简单查看答案及解析
-
常温下,用 0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
溶液所得滴定曲线如下图。下列说法正确的是
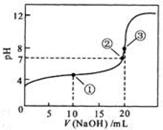
A、点①所示溶液中:
B、点②所示溶液中:
C、点③所示溶液中:
D、滴定过程中可能出现
难度: 简单查看答案及解析
-
常温下,下列有关叙述正确的是
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③
D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH=7,所得溶液体积V(总)≥20mL
难度: 简单查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是
A.c(K+)+ c(H+)= c(HC2O4-)+ c(OH-)+ c(C2O42-) B.c(HC2O4-)+ c(C2O42-)= 0.1 mol·L-1
C.c(H2C2O4)>c(C2O42-) D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
难度: 简单查看答案及解析
-
把足量熟石灰放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s)
Ca2+(aq)+2OH-(aq),下列叙述正确的是
A. 给溶液加热,溶液的pH升高
B. 恒温下向溶液中加入CaO,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
D. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
难度: 简单查看答案及解析
-
在恒温恒容条件下,向容积为2L的密闭容器中充入2.0molSO2和2.0molO2。已知:2SO2(g)+O2(g)
2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
A、在1min时:c(SO3)+c(SO2)=1.0 mol·L-1
B、在2min内:v(SO2)=0.25 mol·L-1·min-1
C、若再充入2molSO3,达到平衡时SO3的质量分数减小
D、反应条件相同,若起始时向反应容器充入2molSO3,达到平衡时反应吸热0.75 akJ
难度: 简单查看答案及解析
-
(7分) t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw=________。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=________。
3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________。
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因________。
难度: 简单查看答案及解析
-
6分)
(I)常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0. 5L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
(II)在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-)________。
(2)若加入更多的AgI固体,则c(Ag+)________
(3)若加入固体AgBr,c(I-)________。
难度: 简单查看答案及解析