-
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水________氢氧化钠(填“<” 、“=” 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性,________消耗的盐酸多。反应生成的氯化铵溶液呈________(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)________
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置。可以观察到的现象是________,产生该现象的原因是(用离子方程式和简要文字表达)________
高二化学填空题简单题查看答案及解析
-
常温下有浓度均为0.1mol•L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水.请根据题目要求回答下列问题.
(1)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是______.
(2)取适量溶液④,加入少量氯化铵固体,此时溶液中的值______(填“增大”或“减小”或“不变”).
(3)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是:______. 所得溶液的pH<7,用离子方程式表示其原因______;混合后的溶液中由水电 离
出的c(OH-)______0.1mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”).
(4)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=______.
(5)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是______.
(6)有相同温度下相同浓度的四种盐溶液:A.NH4HCO3;B.CH3COONH4;C.(NH4)2SO4; D.NH4Cl,按pH由大到小的顺序排列______(填序号)
高二化学解答题中等难度题查看答案及解析
-
电解质溶液相关问题
(1)下列事实可证明氨水是弱碱的是_______(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1 mol· L-1氯化铵溶液的pH 为5
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于7,则溶液中c(H2CO3)_______c(CO32-)(填“>”、 “=”或“<”),原因是________(文字说明);常温下,已知0.1 mol·L-1NaHCO3溶液的pH等于8,则溶液中c(H2CO3)-c(CO32-)=_____________mol··L-1(写出计算数值结果)。
(3)现有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是_____________。
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1 mol·· L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
(4)用标准浓度的酸性KMnO4溶液滴定草酸(H2C2O4)溶液的测定其物质的量浓度。
① 滴定时,KMnO4溶液应装在__________(填“酸式”、“碱式”)滴定管中。
②滴定达到终点的标准是:__________________。
③滴定时所发生反应的离子方程式:_____________________。
④实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是___________。
A.称取草酸晶体(7.2g)时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失
高二化学简答题中等难度题查看答案及解析
-
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: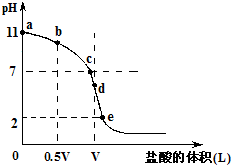
(1)氨水的电离方程式为______,该温度时氨水的电离平衡常数K=______.
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为______.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有______.
A.c(H+)•c(OH-) B.C.
D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)______.
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=______,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为______.高二化学解答题中等难度题查看答案及解析
-
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题:
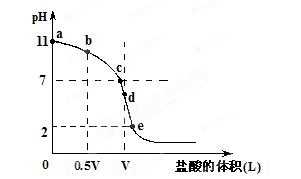
(1)氨水的电离方程式为________,该温度时氨水的电离平衡常数K=________。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为________。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有________。
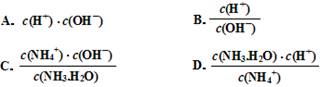
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)________。
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=________,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为________。
高二化学填空题简单题查看答案及解析
-
盐酸、醋酸和氨水是中学化学中常见的三种物质,某校实验小组利用浓盐酸、冰醋酸和浓氨水分别配制了浓度均为0.1 mol·L-1的三种溶液各100 mL并进行相关实验,据此回答下列问题:
(1)常温下上述三种溶液的PH由大到小的顺序是____________________。
(2)25℃时,利用pH试纸测得0.1 mol·L-1醋酸溶液的pH约为5,则可以估算出醋酸的电离常数约为__________________;向10 mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中
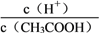 的值将_________(填“增大”“减小”或“无法确定”)。
的值将_________(填“增大”“减小”或“无法确定”)。(3)将浓度均为0.1 mol·L-1的盐酸和氨水等体积混合,则:①所得混合溶液显_______性(填“酸性”“碱性”或“中性”),原因是__________________(用离子方程式表示)。
②所得混合溶液中所有离子的物质的量浓度由大到小的顺序为______。
高二化学填空题中等难度题查看答案及解析
-
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体 B.将溶液稀释到原体积的 10倍
C.加入等体积0.2 mol·L-1氨水 D.降低溶液的温度
高二化学选择题中等难度题查看答案及解析
-
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体 B.将溶液稀释到原体积的 10倍
C.加入等体积0.2 mol·L-1氨水 D.降低溶液的温度
高二化学选择题中等难度题查看答案及解析
-
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.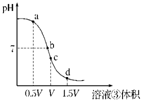
高二化学解答题中等难度题查看答案及解析
-
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是___________(填编号,下同),溶液中溶质存在电离平衡的____________
(2)比较①、②溶液,pH值较大的是____________;
(3)在溶液④中加入少量NH4Cl固体,此时c(NH4+)/c(OH−)的值将___________(填“变小”、“变大”或“不变”);
高二化学填空题简单题查看答案及解析