-
下列叙述中,正确的是( )
A.1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
B.σ键是镜面对称,而π键是轴对称
C.在能层、能级、以及电子云的伸展方向确定时,电子的运动状态才能确定下来
D.在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.s区都是金属元素 B.s区都是主族元素
C.稀有气体在ds区 D.所有非金属元素都在p区
难度: 简单查看答案及解析
-
下列关于化学键的说法中正确的是( )
A.金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性
B.配位键常用A→B表示,其中A原子可以提供接受孤电子对的空轨道
C.含有π键的分子在反应时,π键是化学反应的积极参与者
D.金属元素原子和非金属元素原子间只能形成离子键
难度: 简单查看答案及解析
-
现有三种元素的基态原子的电子排布式如下:① [Ne]3s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A.最高正化合价:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.第一电离能:③>②>①
难度: 简单查看答案及解析
-
下列各组物质中,互为同系物的是( )
A.
与
B.HCOOCH3 与CH3COOCH3
C.
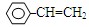 与CH3—CH=CH2 D. CH3OH与HO—CH2—CH2—OH
与CH3—CH=CH2 D. CH3OH与HO—CH2—CH2—OH难度: 简单查看答案及解析
-
下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.H2Se沸点比H2S的沸点高 D.NH3极易溶于水
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.金刚石晶体中,碳原子数与C—C键数之比为1:2
B.720g C60晶体含有NA个如图中晶胞单元

C.离子晶体中每个离子周围均吸引着6个带相反电荷的离子
D.Cu的堆积方式是面心立方最密堆积,配位数是8
难度: 简单查看答案及解析
-
冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
难度: 简单查看答案及解析
-
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其中下图是已经合成的最著名的硫-氮化合物的分子结构。下列说法正确的是( )

A.该物质的分子式为SN B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点 D.该物质与化合物S2N2互为同素异形体
难度: 简单查看答案及解析
-
下面的排序错误的是( )
A.硬度由大到小:金刚石>碳化硅>晶体硅
B.熔点由高到低:Al >Mg>Na
C.晶格能由大到小: NaF> NaCl> NaBr>NaI
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.有些物质是由分子直接构成的,如二氧化碳、二氧化硅;有些物质是由原子直接构成,如金刚石、晶体硅;有些是由离子直接构成的,如氯化铵
B.分子是保持物质性质的一种微粒,且是化学变化中的最小微粒
C.在水溶液中能电离出自由移动离子的晶体不一定是离子晶体
D.使晶体中化学键断裂的变化一定是化学变化
难度: 简单查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
难度: 简单查看答案及解析
-
为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是( )
A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
难度: 简单查看答案及解析
-
下列关于
 的说法正确的( )
的说法正确的( )A.该分子苯环上的一氯代物有3种 B.该分子中的碳原子都是sp2杂化
C.该分子存在非极性键 D.该分子中所有原子都可能在同一个平面上
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
难度: 简单查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
表述Ⅰ
表述Ⅱ
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比PbH4分子稳定性高
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小
C
金属晶体具有良好的延展性
金属晶体中的原子层可以发生相对滑动但不会改变原来的排列方式,也不会破坏金属键
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
难度: 简单查看答案及解析
-
下列有关冰晶体关说法正确的是( )
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
难度: 简单查看答案及解析
-
X、Y都是IIA(Be除外)的元素,已知它们的碳酸盐的热分解温度:T(XCO3)>T(YCO3),则下列判断正确的是( )
A.晶格能: XCO3>YCO3 B.阳离子半径: X2+>Y2+
C.金属性: X>Y D.氧化物的熔点: XO>YO
难度: 简单查看答案及解析
-
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )
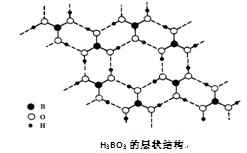
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e-稳定结构
D.含1molH3BO3的晶体中有3mol氢键
难度: 简单查看答案及解析
-
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+ 和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如右图所示。下列说法正确的是( )
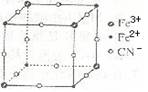
A.该晶体的化学式为MFe2(CN)6
B.该晶体属于离子晶体,M呈+1价
C.该晶体属于离子晶体,M呈+2价
D.晶体中与每个Fe3+距离最近且等距离的CN-为3个
难度: 简单查看答案及解析
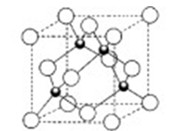
 中含有的官能团的名称为 。与其含有相同官能团,且分子结构中苯环上只有一个取代基的同分异构体有________种。写出它们的结构简式________。
中含有的官能团的名称为 。与其含有相同官能团,且分子结构中苯环上只有一个取代基的同分异构体有________种。写出它们的结构简式________。