-
下列各组中的X和Y两种原子,在周期表中一定位于同一族的是
A. X原子和Y原子最外层都只有一个电子
B. X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C. X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
D. X原子2p能级上有三个电子,Y原子的3p能级上有三个电子
难度: 中等查看答案及解析
-
“防晒霜”之所以能有效地减轻紫外光对人体的伤害,是因为它所含的有效成分的分子中有π键,如氨基苯甲酸、羟基丙酮等。这些有效成分分子中的π电子可在吸收紫外光后被激发,从而阻挡部分紫外光对皮肤的伤害。下列分子中不含有π键的是( )
A. 乙炔分子 B. 乙烷分子 C. 氮气分子 D. 乙烯分子
难度: 中等查看答案及解析
-
下列各组物质汽化或熔化时,所克服的微粒间的作用力属同种类型的是( )
A. 二氧化硅和生石灰的熔化 B. 碘和干冰的升华 C. 氯化钠和铁的熔化 D. 食盐和冰的熔化
难度: 中等查看答案及解析
-
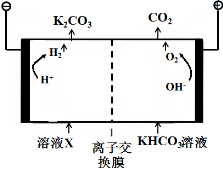
化学是建立在实验基础上的学科。关于下列各实验装置的叙述中,不正确的是
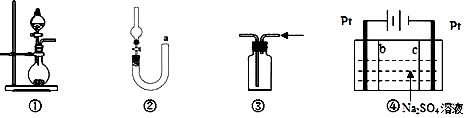
A. 装置①可用于实验室制取少量 NH3 或 O2
B. 可用从 a 处加水的方法检验装置②的气密性
C. 实验室可用装置③收集 H2、NH3
D. 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素,X的一种原子没有中子,Y、Z易形成质量比为3︰4和3︰8的两种常见化合物,W所在的周期数和族序数相同。下列说法正确的是( )
A. W的最高价氧化物对应水化物是强碱 B. 原子最外层电子数:W>Z>Y
C. 原子半径:Y<Z<W D. X、Y可以形成既有极性键也有非极性键的化合物
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合
B. 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O,向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较现象
C. 已知4H++4I﹣+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol/L KI溶液、0.1 mol/L稀硫酸外,还需要用到淀粉溶液
D. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
难度: 中等查看答案及解析
-
下列各项叙述正确的是( )
A. 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B. 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
C. 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
D. 24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
难度: 中等查看答案及解析
-
下列对分子及其性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子
C. 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0
D. 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物
难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。四种物质在冰醋酸中的电离
常数如表。从表格中判断以下说法中不正确的是( )
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10﹣5
6.3×10﹣9
1.6×10﹣9
4.2×10﹣10
A. 在冰醋酸中高氯酸是这四种酸中最强的酸
B. 在冰醋酸中这四种酸都没有完全电离
C. 在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42﹣
D. 酸的强弱与其本身的结构和溶剂的性质有关
难度: 困难查看答案及解析
-
科学家将水置于一个足够强的电场中,在20℃时水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是( )
A. 暖冰中水分子是一种非常稳定的化合物,这是由于氢键所致
B. 暖冰中水分子的各原子均满足8电子稳定结构
C. 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
D. 水凝固形成20℃时的“暖冰”所发生的变化是化学变化
难度: 中等查看答案及解析
-
下列有关SO2和CO2的说法正确的是
A.都是非极性分子
B.中心原子都采取sp杂化
C.S原子和C原子都没有孤对电子
D.SO2为V形结构,CO2为直线形结构
难度: 中等查看答案及解析
-
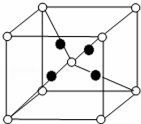
CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22﹣的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
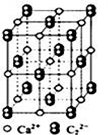
A. 6.4 g CaC2晶体中含阴离子0.2 mol
B. 1个Ca2+周围距离最近且等距离的C22﹣数目为6
C. 该晶体中的阴离子与N2是互为等电子体
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
难度: 困难查看答案及解析
-
已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol﹣1,2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol﹣1,H-H、O=O和O-H键能分别为436、496和462 kJ·mol﹣1,则a为( )
A. -332 B. +350 C. -130 D. +130
难度: 中等查看答案及解析
-
2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g)
2C(g)+zD(g),2 s后A的转化率为50%,测得υ(D)=0.25 mol·L﹣1·s﹣1,下列推断不正确的是( )
A. z=2 B. 2 s后,容器内的压强是初始的7/8倍
C. 2 s后,B的浓度为0.5 mol/L D. 2 s时C的体积分数为2/7
难度: 中等查看答案及解析
-
有一混和液可能由NaOH、NaHCO3、Na2CO3中的一种或两种组成.现取等体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1 mL和V2 mL,如,V1<V2<2V1,则上述溶液中的溶质是( )
A. NaHCO3 B. Na2CO3 C. NaHCO3、Na2CO3 D. Na2CO3、NaOH
难度: 困难查看答案及解析
-
下列叙述正确的个数是( )
①配位键在形成时,是由成键双方各提供一个电子形成共用电子对 ②s-s σ键与s-p σ键的电子云形状相同 ③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素 ④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O2,CO2这样的分子 ⑤冰中存在极性共价键和氢键两种化学键的作用 ⑥Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中 ⑦熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐 ⑧中心原子采取sp3杂化的分子,其立体构型不一定是正四面体形 ⑨键长:C-H<N-H<O-H ⑩第一电离能:Si<C<N<O<F
A. 1 B. 2 C. 3 D. 4
难度: 困难查看答案及解析
-
向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )
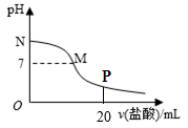
A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M点对应的盐酸体积为10.0 mL
C. P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
D. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
难度: 困难查看答案及解析
-
常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是 ( )
A.HA较强 B.HB较强 C.两者一样 D.无法比较
难度: 中等查看答案及解析
-
增强铝的耐腐蚀性,现以铅蓄电池以外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使表面表面的氧化膜增厚。反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (I)
电解池:2Al+3H2O
Al2O3+3H2↑
电解过程中,以下判断正确的是
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3mol Pb
生成2mol Al2O3
C
正极:PbO2+4H++2e-═Pb2++2H2O
阳极:2Al+3H2O-6e-═Al2O3+6H+
D
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A. NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)= c(HRO3-)+2c(RO32﹣)
B. 常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C. 常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③
D. 常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液 ②pH=3的HCl溶液 ③pH=11
的氨水中由水电离出的c(H+):①>③>②
难度: 困难查看答案及解析