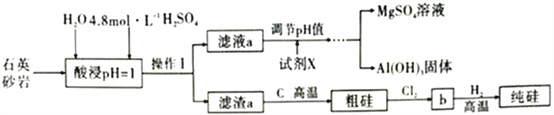
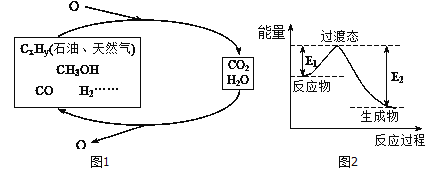
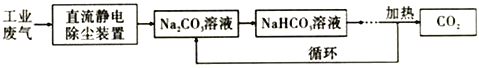
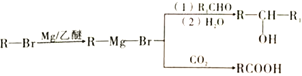
-
化学与生产、生活社会密切相关,下列有关说法正确的是( )
A. 用食醋浸泡有水垢(主要成分为CaCO3) 的水壶,可以清除其中的水垢,这是利用了醋酸的氧化性
B. 白居易在《问刘十九》中有“绿蚁新醅酒,红泥小火炉”诗句,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应
C. 地沟油在碱性条件下水解可以生成高级脂肪酸盐和甘油
D. 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
难度: 中等查看答案及解析
-
设N A为阿伏加德罗常数的值,下列有关说法正确的是( )
A. 46g乙醇中含有的共价键总数为7NA
B. FeBr2与等物质的量的Cl2充分反应时转移的电子数为3NA
C. 标准状况下,2.24LCHCl3中含有0.3NA 个氯原子
D. 常温常压下,2.0g重水(D2O) 中含有NA 个中子
难度: 中等查看答案及解析
-
下列有关有机化合物的说法正确的是( )
A. “间二甲苯”中苯环上的一个氢原子被“-C2H3Cl2” 取代时,形成的同分异构体最多有9种
B. 将等物质的量的C2H 6与Cl2混合在光照条件下,充分反应可以制得纯净的氯乙烷
C. 苯与液溴混合后加入铁粉,此时苯发生了加成反应
D. 食物中的纤维素在人体内可以水解生成葡萄糖,为人类活动提供能量
难度: 困难查看答案及解析
-
下列有关实验操作、现象和结论或解释均正确的是( )
选项
实验操作
实验现象
结论或解释
A
用镊子夹取一块金属钠并用滤纸吸干表面的煤油,用小刀切开一端的外皮
切口处呈银白色,很快变成淡黄色
常温下,钠与O2 反应生成了Na2O2
B
向盛有 4mL0.1mol· L-1的 NaOH 溶液的试管中滴加等浓度的MgSO4溶液2mL 后,再滴加0.1mol· L -1CuSO4溶液
先产生白色沉淀后沉淀变为蓝色
Cu(OH)2的Ksp比Mg(OH)2 的小
C
焰色反应实验时,某同学用洁净的铂丝蘸取样品在无色火焰上灼烧
直接观察到火焰的颜色呈黄色
该样品中含有钠元素,一定不含钾元素
D
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量
试管中溶液先变红后褪色,最后有白色沉淀
非金属性:Cl>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
五种短周期元素A、B、C、D、E的原子序数依次增大,其中A、C和B、D均在同主族且B和C形成的简单离子具有相同的电子层结构; C 是短周期主族元素中金属性最强的元素,C、 E形成的离子化合物其水溶液呈中性,则下列说法不正确的是( )
A. B 与C形成的化合物溶于水后溶液一定呈碱性 B. A和B之间只能形成共价化合物
C. 形成的气态氢化物的热稳定性:B>D D. 最高价氧化物对应水化物的酸性:E>D
难度: 困难查看答案及解析
-
储氢材料是当前新能源领域研究的一类热门材料。在一定条件下,以Cu-Zn原电池作电源,利用图所示装置可实现有机物的储氢,下列有关说法正确的是( )
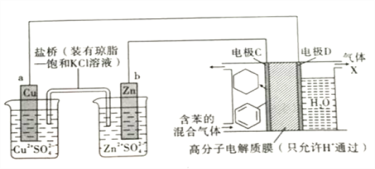
A.在Cu-Zn原电池装置工作时,盐桥内的Cl- 向铜电极一端移动
B.电极C为阳极,在电极D 上发生还原反应
C.气体X的主要成分是H2
D.H+透过高分子膜从右室进入左室,在电极C 上发生还原反应
难度: 困难查看答案及解析
-
已知草酸为二元弱酸,在25℃时,草酸的两步电离常数为: Ka1=5.0×10-2,Ka2=m。实验测得在该温度下改变0.1mol· L-1的H2C2O4溶液的pH 值时,溶液中主要微粒的物质的量分数δ(X) 随pH值的变化如图所示[已知:①δ( H2C2O4)=
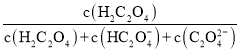 ②1g5=0.7;③图中b点对应的pH值为2.7]。则下列说法不正确的是( )
②1g5=0.7;③图中b点对应的pH值为2.7]。则下列说法不正确的是( )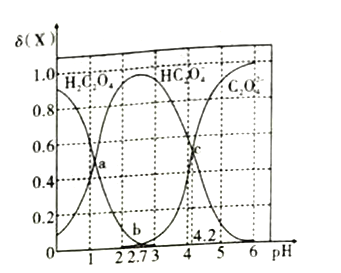
A. 在a点,溶液对应的pH值为1.3 B. pH= 2.8 时,c(HC2O4-)>c(C2O42-)+c(H2C2O4)
C. pH=4.2时,c(HC2O4-)=c(C2O42-)=c(H+) D. lgKa2=-4.2
难度: 困难查看答案及解析