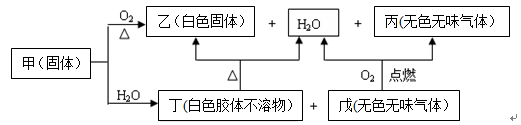
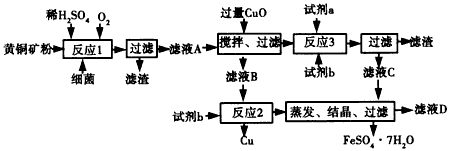
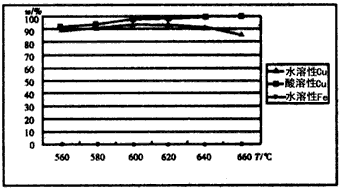
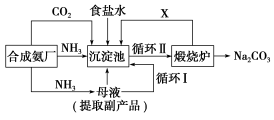
-
下列有关化学知识在生产、生活中应用的叙述正确的是
①工业上合成新型氮化硅(Si3N4)陶瓷需要在高温、空气气氛中进行 ②钢铁制品锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳 ③海水淡化和工业生产及生活废水的再利用,是解决缺水问题的有效途径 ④高铁酸钠(Na2FeO4)和ClO2都能作净水剂,其原理完全相同 ⑤液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰⑥石油分馏、煤的气化、煤的干馏、海水制盐等都属于化学变化过程⑦水泥、玻璃、陶瓷是人们在生产、生活中用量最大的无机非金属材料⑧NO2、SO2 、CO2、PM2.5都是空气质量日报必须报道的大气污染物
A.①②③ B.②④⑧ C.③④⑤ D.③⑤⑦
难度: 简单查看答案及解析
-
如果你家里的食用花生油不小心混入了部分水,利用你所学的知识,采用最简便的分离方法是
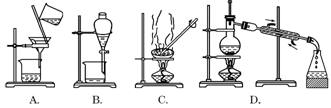
难度: 中等查看答案及解析
-
用Pt电极电解含有Ag+、Cu2+和X3+各0.1mol的溶液,阴极析出固体物质的质量与回路中通过电子的物质的量的关系如图所示.则下列氧化性强弱的判断正确的是
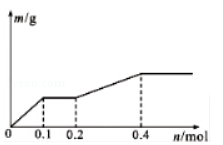
A.Ag+>X3+>Cu2+>H+>X2+ B.Ag+>Cu2+>X3+>H+>X2+
C.Cu2+>X3+>Ag+>X2+>H+ D.Cu2+>Ag+>X3+>H+>X2+
难度: 简单查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.标准状况下产物NO的体积为22.4L
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.参加反应的硝酸的物质的量为0.1mol
难度: 中等查看答案及解析
-
从某些性质看:NH3和H2O,NH2-和OH-,N3-和O2-两两相似,据此判断下列反应正确的是
①2Na+2NH3=2NaNH2+H2↑ ②CaO+2NH4Cl
CaCl2+2NH3↑+H2O
③3Mg(NH2)2
Mg3N2+4NH3↑ ④NH4Cl+NaNH2
NaCl+2NH3↑
A.③ B.② C.②③ D.①②③④
难度: 困难查看答案及解析
-
铝碳酸镁[AlaMgb·(CO3)c·(OH)d·eH2O]用于慢性胃炎,称取3.0g铝碳酸镁样品,溶于50mL 2mol/L的盐酸(过量),收集到气体112mL(标准状况);往所得溶液中加入40mL 3mol/L的NaOH溶液,过滤,将所得沉淀洗涤、干燥、称量得固体1.74g;再将滤液稀释到100mL,测得溶液中OH-的浓度为0.1mol/L,由计算可以确定e的值为
A.4 B.5 C.7 D.8
难度: 简单查看答案及解析
-
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵ 在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶ 在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
A.SO42-、AlO2─、Na+ B.Na+、CO32─、AlO2─
C.CO32─、Na+、Al3+ D.MnO4─、Na+、CO32─
难度: 简单查看答案及解析