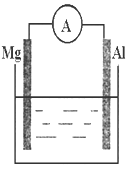
-
已知H2(g)+
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是
A.2SO2+O2
2SO3 ΔH=-196.6 kJ·mol-1
B.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-1
C.
H2(g)+
Cl2(g)===HCl(g) ΔH=-92.5 kJ·mol-1
D.H+(aq)+OH-(aq)===H2O(l) ΔH=+57.3 kJ
难度: 中等查看答案及解析
-
要增大锌与盐酸反应的速率,所采取的下列措施无效的是
A.增大盐酸的浓度 B.提高反应的温度
C.用锌粉代替锌片 D.用纯锌代替粗锌
难度: 中等查看答案及解析
-
已知:在一定温度下,H2(g) + I2(g)
2 HI(g)的平衡常数为K1;1/2H2(g) + 1/2I2(g)
HI(g)的平衡常数为K2,则K1、K2的关系为
A.K1=K2 B.K1=2K2 C.K1=1/2K2 D.K1=K2
难度: 中等查看答案及解析
-
下列物质对水的电离起抑制作用的是
A.HCl B.NH4Cl C.CH3COONa D.NaCl
难度: 中等查看答案及解析
-
某温度时,测得纯水中c(H+)=2×10-7 mol/L,则此时c(OH-)为
A.0.5×10-7 mol/L B.1×10-7 mol/L
C.2×10-7 mol/L D.4×10-7 mol/L
难度: 简单查看答案及解析
-
下列溶液一定呈酸性的是
A.pH<7的溶液 B.c(H+)>c(OH—) 的溶液
C.pH>7的溶液 D.c(H+)<c(OH—) 的溶液
难度: 简单查看答案及解析
-
pH均为5的NH4Cl溶液和稀盐酸中,由水电离出的H+浓度比较
A.一样大 B.前者大 C.后者大 D.无法判断
难度: 中等查看答案及解析
-
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH—)>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
C.c(OH—)>c(B-)>c(A-)>c(H+) D.c(OH—)>c(HB)>c(HA)>c(H+)
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI
C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
难度: 中等查看答案及解析
-
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
A.加MgCl2 B.加H2O C.加NaOH D.加HCl
难度: 中等查看答案及解析
-
下面几种情况,能够形成原电池的是

难度: 中等查看答案及解析
-
关于下图所示的原电池,下列说法正确的是
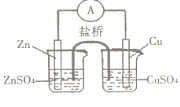
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.取出盐桥后,电流计的指针仍发生偏转
D.铜电极上发生的电极反应是2H+ + 2e- = H2↑
难度: 中等查看答案及解析
-
根据下图,判断下列说法中错误的是

A.导线上电子由Ag极流向石墨极
B.负极电极反应式:Fe3+ + e-=Fe2+
C.盐桥中阴离子移向AgNO3溶液
D.总反应为:Fe3+ + Ag=Fe2+ + Ag+
难度: 中等查看答案及解析
-
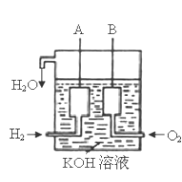
为体现“城市让生活更美好”的主题,上海市政府承诺世博园区内交通“零排放”、园区周边交通“低排放”。2010年4月15日新能源车交车仪式在世博园举行,该车装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的是
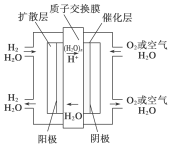
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
难度: 困难查看答案及解析
-
用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是
A.Na2SO4 B.NaNO3 C.KOH D.CuSO4
难度: 中等查看答案及解析
-
镍--镉(Ni--Cd)可充电电池可以发生如下反应:
Cd(OH)2 + 2Ni(OH)2
Cd + 2NiO(OH)+ 2H2O
由此可知,该电池充电时的阳极是
A.Cd B.NiO(OH) C.Cd(OH)2 D.Ni(OH)2
难度: 中等查看答案及解析
-
下列关于金属腐蚀的说法中不正确的是
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.金属腐蚀一般包括化学腐蚀和电化学腐蚀
C.钢铁在酸性环境中会发生吸氢腐蚀
D.纯的金属一般难以发生电化学腐蚀
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是
A.HCOOH + H2O
HCOO- + H3O+
B.CO2 + H2O
HCO3- + H+
C.CO32- + H2O
HCO3- + OH-
D.HS- + H2O
S2- + H3O+
难度: 简单查看答案及解析
-
为了使K2S溶液中[K+]/[S2—]的比值变小,可加入的物质是
①适量的HCl;②适量的NaOH;③适量的KOH;④适量的NaHS。
A.②③ B.①② C.③④ D.②④
难度: 中等查看答案及解析