-
下列说法不正确的是
A.碳酸钠不能用于治疗胃溃疡病人的胃酸过多症
B.切开的金属Na暴露在空气中,光亮表面会逐渐变暗
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,可以使用泡沫灭火器来灭火
难度: 中等查看答案及解析
-
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是

A.IO4-作氧化剂
B.若有1 mol Mn2+参加反应转移5 mol电子
C.氧化剂与还原剂的物质的量之比为5∶2
D.配平后Mn2+、H+的化学计量数分别为2、3
难度: 中等查看答案及解析
-
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是
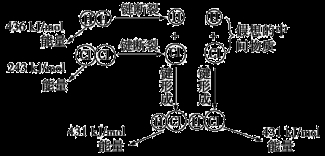
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.此反应的热化学方程式为H2(g)+Cl2(g)
2HCl(g) ΔH=+183 kJ·mol-1
D.此反应的热化学方程式为1/2H2(g)+1/2Cl2(g)
HCl(g) ΔH=-91.5 kJ·mol-1
难度: 中等查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
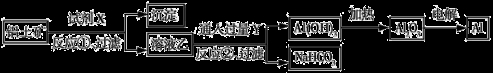
下列叙述正确的是
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2 + CO2 +2H2O
Al(OH)3↓ + NaHCO3
难度: 中等查看答案及解析
-
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
W
X
Y
Z
A.四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W)
B.四种元素形成的单质最多有6种
C.四种元素均可与氢元素形成电子总数为18的分子
D.四种元素中,Z的最高价氧化物对应的水化物酸性最强
难度: 中等查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
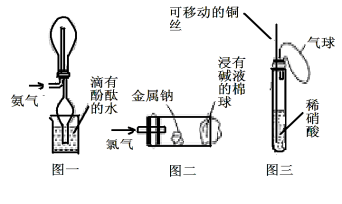
①实验室收集氨气采用图一所示装置
②实验室中做氯气与钠反应实验时采用图二所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图三所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
难度: 困难查看答案及解析
-
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数
K a=1.75×10-5
K a=2.98×10-8
Ka1=4.30×10-7 Ka2=5.61×10-11
Ka1=1.54×10-2 Ka2=1.02×10-7
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为: SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO- =CO32-+2HClO
难度: 困难查看答案及解析