-
为了控制大气污染和缓解城区主要道路交通压力,2017年12月河南省多地市对机动车施行单双号限行政策。下列有关说法正确的是( )
A. 机动车尾气中的CO 是酸性氧化物
B. 机动车尾气中SO2的水溶液可以导电,故SO2 是电解质
C. 机动车在怠速状态下产生的积碳颗粒,易导致空气中PM2.5 (可入肺颗粒物)含量升高
D. 为方便出行,经济条件好的家庭可以考虑再购买一辆机动车,以保证单双号日均有车能开
难度: 简单查看答案及解析
-
第二架国产大型客机C919将在本月底实现首飞。C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是( )
A. 铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B. 改变原料的配比,可以制得性能不同的铝锂合金
C. 铝锂合金具有金属光泽,可导电导热
D. 铝锂合金的性质与各成分金属的性质完全相同
难度: 中等查看答案及解析
-
下列现象或应用与胶体性质无关的是( )
A. 泡沫灭火器中将Al2(SO4)3与NaHCO3溶液混合后,喷出大量泡沫,起到灭火作用
B. 冶金厂常用高压电除去烟尘
C. 夏日的傍晚常常看到万丈霞光穿云而过美不胜收
D. 向氢氧化铁胶体中滴加稀硫酸,开始时产生沉淀,继续滴加时沉淀溶解
难度: 简单查看答案及解析
-
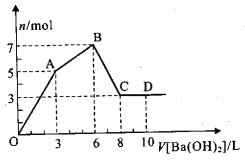
下列说法正确的是( )
①有单质参加或生成的反应一定是氧化还原反应
②向Al2(SO4)3溶液中逐滴滴加Ba(OH)2溶液,先生成白色沉淀,后沉淀消失
③向含有BaCl2和NaOH的混合溶液中通入少量的二氧化硫气体,有白色沉淀生成
④向CaCl2溶液中通入足量二氧化碳气体,先生成白色沉淀,后沉淀消失
⑤101kPa、150℃时,agCO和H2的混合气体在足量的O2中完全燃烧,将燃烧后的产物通入足量的Na2O2固体后,Na2O2增重ag
⑥为测定熔融氢氧化钠的导电性,可在刚玉(主要成分是Al2O3) 坩埚中熔化氢氧化钠固体后进行测量
⑦碱性氧化物一定是金属氧化物
⑧22.4L的CO气体和28gN2所含的电子数相等
A. ①②④⑥⑧ B. ③④⑤ C. ①⑤⑥⑦ D. ③⑤⑦
难度: 困难查看答案及解析
-
下列除杂方式正确的是( )
A. H2气体中含有少量的CO2杂质可以通过灼热的炭粉除去
B. CO2气体中含有的少量HCl杂质可通过饱和Na2CO3溶液除去
C. K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯
D. NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去
难度: 中等查看答案及解析
-
实验室下列物质的保存方法中,不正确的是( )
A. 氯化亚铁溶液存放在加有少量铁粉的试剂瓶中
B. 氢氧化钠溶液盛装在广口试剂瓶中
C. 过氧化钠要密封保存
D. 铝片放在不密封的容器里
难度: 中等查看答案及解析
-
下列哪一个实验,不仅产生气体,而且最终一定能产生白色沉淀( )
A. 将少量的Na投入到Ca(HCO3)2溶液中
B. 将过量的Na2O2投入到FeSO4溶液中
C. 将过量的Na投入到KAl(SO4)2溶液中
D. 将少量的Mg投入到NaOH溶液中
难度: 困难查看答案及解析
-
下列化学实验事实及其解释正确的是( )
A. 加热铝箱,铝并不滴落,说明铝具有很高的熔点
B. 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O2再与水和二氧化碳反应
C. 活性炭使红墨水褪色,是因为活性炭具有强氧化性
D. 用胶头滴管向包有Na2O2的脱脂棉滴加几滴水,脱脂棉燃烧,说明H2O与Na2O2的反应是放热反应
难度: 中等查看答案及解析
-
在杠杆的两端分别挂着质量和体积都相同的空心铝球和铜球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铁溶液中片刻,如图,则下列说法正确的是( )
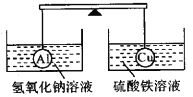
A. 在浸没过程中,杠杆始终保持平衡 B. 两边烧杯中的溶液质量均增加了
C. 两烧杯中均无气泡产生 D. 右边铜球质量不变
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A. 苏打溶液与少量澄清石灰水混合: Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
B. 向HI溶液中加入Fe2O3: Fe2O3+6H+=2Fe3++3H2O
C. 向Fe(NO3)2溶液中加入稀硫酸: 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
D. AlCl3溶液中加入过量的氨水: Al3++4OH-=AlO2-+2H2O
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是( )
A. 某溶液中加入金属铁有氢气放出: K+、Ca2+、CH3COO-、Cl-
B. 某透明溶液中:Cu2+、Mg2+、NO3-、SO42-
C. 使酚酞试液变红的溶液中: Na+、HCO3-、NO3-、Ba2+
D. 某无色溶液中: Al3+、K+、AlO2-、Cl-
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
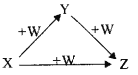
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
难度: 中等查看答案及解析
-
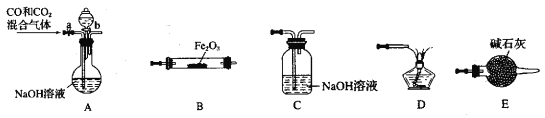
下列实验装置及操作均正确的是
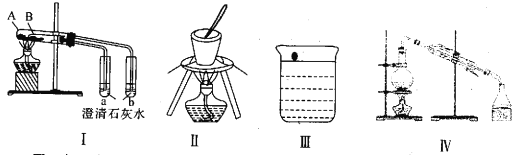
A. 图Ⅰ中A 盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B. 图Ⅱ可用于灼烧氢氧化铁固体制备铁红
C. 图Ⅲ为钠与水的反应现象探究实验的装置
D. 图Ⅳ为分离多种沸点不同且互溶的液体混合物
难度: 中等查看答案及解析
-
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生
①Tl3++2Ag=Tl++2Ag+,②Cu+2Fe3+=2Fe2++Cu2+,③Ag++Fe2+=Ag+Fe3+,下列离子氧化性比较顺序正确的是
A. Tl3+>Ag+>Fe3+>Cu2+ B. Cu2+>Fe3+>Ag+>Tl3+
C. TI+>Ag+>Fe2+>Cu2+ D. Tl3+>Fe3+>Ag+>Cu2+
难度: 中等查看答案及解析
-
在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2↑中(a、b、c、d、e、f是各物质的化学计量数),若被水还原的BrF3的物质的量是3mol,则被氧化的H2O的物质的量是
A. 1.5mol B. 2mol C. 3mol D. 6mol
难度: 中等查看答案及解析
-
现有CuO、FeO、Fe2O3、Fe3O4组成的混合物m g,向其中加入0.2L2mol/L硫酸,恰好完全溶解,若m g该混合物在过量CO气流中加热充分反应,则冷却后剩余固体的质量为
A. (m-3.2)g B. (m-6.4)g C. (m-9.6)g D. 无法计算
难度: 困难查看答案及解析