-
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O ③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-.
A.①③
B.②④
C.①④
D.②③难度: 中等查看答案及解析
-
下列措施不能达到节能减排目的是( )
A.利用太阳能制氢燃料
B.用家用汽车代替公交车
C.利用潮汐能发电
D.用节能灯代替白炽灯难度: 中等查看答案及解析
-
下列对化学反应的认识,错误的是( )
A.会引起化学键的变化
B.会产生新物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化难度: 中等查看答案及解析
-
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液lmL稀释至100mL后,pH等于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍难度: 中等查看答案及解析
-
用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)难度: 中等查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
A.:He
B.
C.1s2
D.难度: 中等查看答案及解析
-
水是最宝贵的资源之一.下列表述正确的是( )
A.H2O的电子式为
B.4℃时,纯水的pH=7
C.D216O中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)难度: 中等查看答案及解析
-
下列有关实验操作的说法正确的是( )
A.可用25ml碱式滴定管量取20.00mlKMnO4溶液
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的,液体也不能蒸干
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全难度: 中等查看答案及解析
-
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-57.3kJ/mol
B.KOH(aq)+H2SO4(aq)═
K2SO4(aq)+H2O(l)△H=-57.3kJ/mol
C.C8H18(l)+O2(g)═8CO2(g)+9H2O(g)△H=-5518kJ/mol
D.2C8H18(g)+25O2(g)═16CO2(g)+18H2O(l)△H=-5518kJ/mol难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为难度: 中等查看答案及解析
-
在一密闭容器中,反应 aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析
-
25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )物质 X Y Z 初始浓度/mol•L-1 0.1 0.2 平衡浓度/mol•L-1 0.05 0.05 0.1
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y⇌2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数难度: 中等查看答案及解析
-
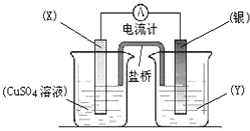
茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定.我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池.在这种电池中①铝合金是阳极 ②铝合金是负极③海水是电解液 ④铝合金电极发生还原反应,说法正确的是( )
A.②③
B.②④
C.①②
D.①④难度: 中等查看答案及解析