-
下列事实不能用勒沙特列原理解释的是( )
A.硫酸工业中,使用过量的空气以提高二氧化硫的利用率
B.配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释
C.实验室常用排饱和食盐水的方法收集氯气
D.二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
难度: 中等查看答案及解析
-
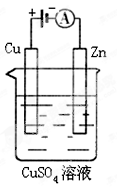
将pH=4的盐酸X L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-4 mol/L的氨水Y L ②c(OH-)=1×10-4mol/L的氨水Z L ③c(OH-)=1×10-4 mol/L的Ba(OH)2溶液W L。 其中X、Y、Z、W的关系正确的是( )
A.Y>X=W>Z B.X=Y>Z>W C.X=Y>W>Z D.Z>X=W>Y
难度: 困难查看答案及解析
-
下列反应在任意温度下一定能自发进行的是( )
A.2NaCl+2H2O
2NaOH+Cl2↑+H2↑
B.NH3(g)+HCl(g)=NH4Cl(s) ΔH<0
C.CaCO3(s)=CaO(s)+CO2(g) ΔH>0
D.X2Y2(g)=X2(g)+Y2(g) ΔH<0
难度: 简单查看答案及解析
-
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25 ℃)
8.0×10-16
2.2×10-20
4.0×10-38
完全沉淀时的pH值
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
难度: 困难查看答案及解析
-
下列各组离子能在指定溶液中,可能大量共存的是( )
①无色溶液中:K+、Na+、CO32—、SO42—
②pH=11的溶液中:Na+、Ba2+、AlO2—、ClO—
③水电离出的c(H+) =10—12mol·L—1的溶液中:Mg2+、NH4+、HCO3—、S2—
④加入Al放出H2的溶液中:Cu2+、NH4+、Cl—、NO3—
⑤无色溶液中:K+、Na+、
、
⑥酸性溶液中:Fe2+、Al3+、NO3—、Cl—
A.①②④ B.①②④⑥ C.①② D.①②⑤
难度: 困难查看答案及解析
-
关于吸热反应的说法,正确的是( )
A.凡需加热的反应一定是吸热反应 B.只有分解反应才是吸热反应
C.使用催化剂的反应是吸热反应 D.酸碱中和反应的逆反应是吸热反应
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列图象正确的是( )

难度: 困难查看答案及解析
-
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是( )
A.电解时以硫酸铜溶液作电解液,精铜作阳极
B.粗铜与电源负极相连,发生氧化反应
C.阴极上发生的反应是Cu2+ + 2e-=Cu
D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
难度: 中等查看答案及解析
-
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是( )
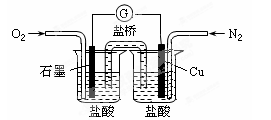
A.此装置能将化学能转变为电能
B.石墨电极的反应式:O2+2H2O+4e—=4OH—
C.电子由Cu电极经导线流向石墨电极
D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O
难度: 中等查看答案及解析
-
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
N2(g)+3H2 (g)
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
改变条件
新平衡与原平衡比较
A
增大压强
N2的浓度一定变小
B
升高温度
N2的转化率变小
C
充入一定量H2
H2的转化率不变,N2的转化率变大
D
使用适当催化剂
NH3的体积分数增大
难度: 中等查看答案及解析
-
已知:HCN(aq)与NaOH(aq)反应的∆H= -12.1kJ/mol;HCl(aq)与NaOH(aq)反应的∆H= -55.6kJ/mol。则HCN在水溶液中电离的∆H等于( )
A.+67.7kJ/mol B.-67.7 kJ/mol C.+ 43.5 kJ/mol D.-43.5 kJ/mol
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.吸热反应只有在加热条件下才能发生,故水不加热不电离
D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性
难度: 中等查看答案及解析
-
在Na2HPO4溶液中,存在着下列平衡:HPO42-
H++PO43-;HPO42-+H2O
H2PO4-+OH-;已知该溶液呈碱性。欲使溶液中的HPO42-、H+、PO43-浓度都减小,可采取的方法是( )
A.加石灰水 B.加盐酸 C.加烧碱 D.用水稀释
难度: 中等查看答案及解析
-
已知25℃,Fe(OH)3(s)
Fe3+(aq)+3OH-(aq),Ksp;Fe3+(aq)+3H2O(l)
Fe(OH)3(s)+3H+(aq),Kh;水的离子积常数为Kw。下列Ksp、Kh、Kw的关系是( )
A.Kh/Kw=Ksp B.Ksp·Kw=Kh
C. Ksp·Kh=(Kw)3 D.Kw/Kh=(Ksp)3
难度: 中等查看答案及解析
-
可逆反应mA(g)+nB(g)
pC(g)+qD(g)的v-t图象如下左图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是( )

A.②③⑤⑧ B.①④⑥⑧ C.②④⑤⑦ D.①③⑥⑦
难度: 中等查看答案及解析
-
关于如图所示各装置的叙述中,正确的是( )
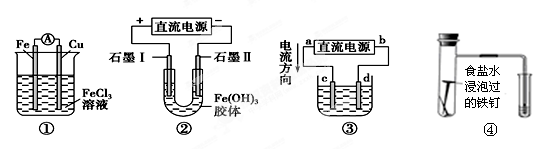
A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2
B.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
C.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.装置④研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e- = Fe2+
难度: 中等查看答案及解析