-
氮化镁(Mg3N2)是工业上应用广泛的离子化合物,通常条件下为黄绿色的粉末,极易与水反应,常用作接触媒。
I.氮化镁的制备
下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框(实验前系统内的空气已排除, 图中箭头表示气体的流向)。
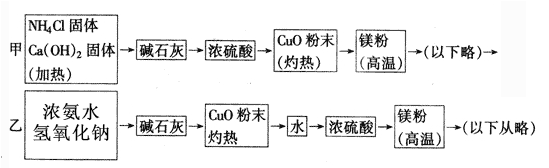
(1)Mg3N2的电子式为__________________。
(2)请结合化学方程式分析乙同学方案中氢氧化钠的作用:_____________________________。
(3)上述方案中,可制得氮化镁的方案为________________。
(4)丙同学利用空气中含有大量N2的事实,用以下装置设计了另外一种制备氮化镁的方案(夹持装置略去):
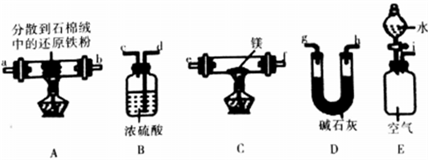
①按气流由左到右的方向,上述装置合理的连接顺序为____________________(填装置字母)。
②装置D的作用为__________________。
Ⅱ.定性分析产物
| 操作步骤 | 实验现象 | 解释原因 |
| 取少量产品于试管中,加足量蒸馏水 | 试管底部有固体不溶物,有刺激性气味的气体产生 | (5)写出反应的化学方程式__________________________ |
| 弃去上层清液,加入足量稀盐酸 | 观察到固体全部溶解且冒气泡 | (6)冒气泡的原因___________ |
Ⅲ.定量测定氮化镁纯度
i.称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol/L盐酸中,充分反应后,将所得溶液稀释到200.00mL
ii.取20.00 mL稀释后的溶液,用0.2 mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25.00 mL
(7)所取固体中氮化镁的质量分数为____________________。
-
钼是一种稀有金属,为人体及动植物必须的微量元素。某化学兴趣小组在实验室模拟了从铜钼精矿(主要含有Cu2S、MoS2、SiO2、P、As等)中提取分离得到氧化钼的过程
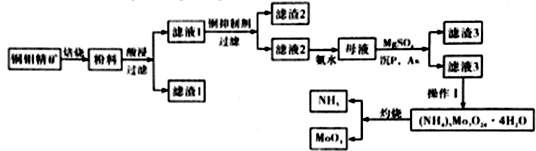
已知:MoO3在869.9K时开始升华
(1)滤渣I的主要成分为__________________。
(2)铜钼精矿中的钼元素在过量的空气中,于一定温度下,很容易被氧化成MoO3,其方程式为________________________,焙烧过程中应控制温度在800~870K左右,其原因为______________。
(3)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24·4H2O的盐。则在控制好NH3与MoO3比例的前提下,操作I为_________________。
(4)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式_______________________;
②由于氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用漂白粉回漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式________________。
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6 的Ksp=1.00×10-16;滤液中Cu2+的浓度为0.5mol/L。当溶液中离子浓度小于1.00×10-3mol/L 时可认为沉淀完全,则欲处理1L滤液需要0.1 mol/L 的Na4[Fe(CN)6]体积为____________(溶液混合体积变化忽略不计,保留两位小数)。
-
亚磷酸(H3PO3,二元中强酸)及其盐在工农业生产中有着重要作用。
已知:25℃时,亚磷酸(H3PO3)的Ka1=5×10-2,Ka2=2.5×10-7
(1)亚磷酸(H3PO3)具有强还原性,可被阴离子氧化为磷酸。则该反应的离子方程式为______________________________________。
(2)试从电离平衡移动的角度解释Ka1、Ka2差异原因_____________。
(3)在稀溶液中H3PO3(aq) H2PO3-(aq)+H+(aq) △H=akJ/mol
H2PO3-(aq)+H+(aq) △H=akJ/mol
H2PO3-(aq) HPO32-(aq)+H+(aq) △H=bkJ/mol
HPO32-(aq)+H+(aq) △H=bkJ/mol
H+(aq)+ OH-(aq)=H2O(l) △H=ckJ/mol
H3PO3(aq)+ 2NaOH(aq) Na2HPO3(aq)+2H2O(l) △H=___________kJ/mol
Na2HPO3(aq)+2H2O(l) △H=___________kJ/mol
(4)亚磷酸氧钠可使碘水褪色,.25℃时,Na2HPO3水解反应的Kb=_____________,若向Na2HPO3溶液中加入少量的I2,则溶液中 将 ______________ (填“增大”、“减小”或“不变”)。
将 ______________ (填“增大”、“减小”或“不变”)。
(5)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
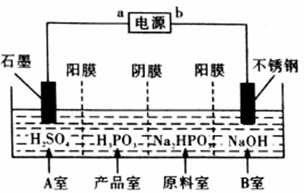
①a为电源_____极(填“正”或“负”)产品室中反应的离子方程式为__________________________。
②得到0.1mol亚磷酸的同时,理论上B室可制得NaOH质量为___________g。
-
硼(B)及其化合物是结构化学的重要研究对象。请回答下列问题:
(1)和B同主族电负性最小的元素[放射性元素(周期表中84号及其后的元素)除外]的价电子排布式为___________,Be、B、C的第一电离能由大到小的顺序是___________________(用元素符号表示)
(2)无机苯(B3N3H6)与苯结构相似,其中B的杂化方式为______________,1mol B3N3H6中σ键的数目为______________________。
(3)Al和B同主族,其化合物氟化铝的熔沸点远远高于氯化铝,试解释其原因________________。
(4)将硼砂(NaB4O7)和NH4C1共热可得白色固体BN和B2O3、方程式_________________________。
氮化硼有两种晶型结构,一种是六方氮化硼,其结构与石墨相似却不导电,原因是__________________;另一种是类似于金刚石结构的立方氮化硼,已知晶胞边长为361.5pm,N原子半径为a pm,则B原子半径为___________pm(只要求列算式)。

(5)碳化硼是除金刚石和氮化硼外最硬的固体,下图是碳化硼的晶胞简图,该图给出了晶胞中的所有原子,除“三原子”(中心原子和其相连的2个原子)外,晶胞的其余原子都是B12多面体中的1个原子,B12多面体的其他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连,若上述三原子都是碳原子,写出碳化硼的化学式_____________________。

-
有机物H是一种在航空航天领域中应用的重要原料,E为一种室内污染气体,Q为酯类高分子物质,请回答:(部分物质及反应条件省略)

已知:
(1)D物质名称为______________,反应②的条件为_________________________。
(2)H+N→Q的反应类型为_________________________。
(3)反应①的化学方程式为________________________________。
(4)反应③的化学方程式为_________________________。
(5)H中最多有多少个碳原子共平面_________,是否具有手性异构__________(填“是”或“否”),
其满足下列条件的同分异构体有________种。
(i) 两个羟基分别连在两个苯环上
(ii)苯环间通过一个碳原子连接在一起,有两个甲基连在该碳原子上
(iii)不含H本身,不考虑立体异构
(6)请写出Q的结构简式:________________。
(7)根据上述合成路线和信息,完成④的多步反应过程:____________________________________。
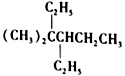 的名称为4, 4-二甲基-3-乙基己烷
的名称为4, 4-二甲基-3-乙基己烷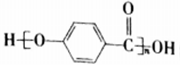 的结构中含有酯基
的结构中含有酯基
2NH3(g),恒温条件下,向某一2L的密闭容器中充入1molN2和
molH2,经10s达到平衡,平衡后压强为初始压强的
。则下列说法正确的是







