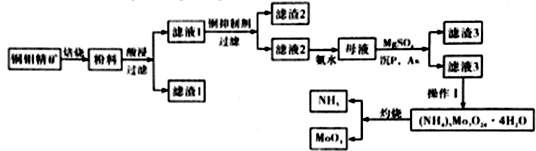
-
钼是一种稀有金属,为人体及动植物必须的微量元素,纯金属钼和钼合金具有强度大、耐高温、耐磨损、耐腐蚀等多种有点,广泛应用于冶金、机械、化工、军工、电光源、润滑剂、航空航天等领域。某化学兴趣小组在实验室模拟了从铜钼精矿(主要含有Cu2S、MoS2,SiO2,P,As等)中提取分离得到氧化钼的过程:
已知:MoO3在869.9K温度下开始升华,而到969.9温度下激烈升华,在溶液中以H2MoO4形式存在
(1)滤渣1的主要成分为_________________________。
(2)铜钼矿中的钼元素在过量的空气中,于一定温度下,很容易氧化成MoO3,其方程式为___________________________________,
焙烧过程中应控制在800-870K左右,其原因为____________________________。
(3)①向滤液1中加入的铜抑制剂有多种,如氰化钠,向含重金属离子的溶液中添加氰化钠,会立即生成沉淀,但是若继续添加氰化钠,沉淀继续与CN-反应,生成[Me(CN)4]2-稳定的配离子,因此需要控制氰化钠的用量,试写出向滤液中加入过量氰化钠的离子方程式_______________________________;
②由干氰化钠有剧毒,所以需要对剩余的氰化钠进行处理,通常选用深漂白粉或漂白液在酸性条件下将其氧化为两种空气中常见无毒气体,试写出漂白液与氰化钠反应的离子方程式_____;
③除氰化钠外,常用的抑制剂还有亚铁氰化钠,Na4[Fe(CN)6]可与重金属阳离子反应,生成溶度积较小的沉淀,已知Cu2Fe(CN)6的Ksp=1.00×10-16;滤液中的Cu2+的浓度为为0.5mol/L、.当溶液中离子浓度小于等于1.00×10-16mol/L时可认为沉淀完全,则欲处理IL滤液的Na4[Fe(CN)6]体积为_________(体积变化忽略不计,保留两位小数)。
(4)当NH3∶MoO3等于或稍大于6∶7时,可从氨溶液中结晶出分子式为(NH4)6Mo7O24• 4H2O的盐。蒸发溶液(把氨除去)或中和溶液(化合部分氨)都可以达到这一比例。则操作I为_______。
-
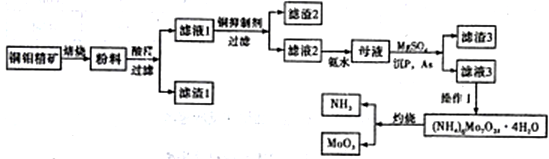
钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4∙2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S、FeS2)回收Mo并制备钼酸钠晶体,其主要流程如图所示:
回答下列问题:
(1)可以提高焙烧效率的措施有__________________(填一条即可)。MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若生成0.1molMoO3,则反应中转移电子的数目为______。
(2)往固体1中加碳酸钠溶液,发生反应的化学方程式为_______________。
(3)操作2为______________、洗涤、干燥。
(4)制备钼酸钠晶体还可通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中还有硫酸钠生成,则反应的离子方程式为___________。
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,溶液中c(CO32-)=_________[已知:Ksp(BaCO3)=2.6×10-9,Ksp(Ba MoO4)=4.0×10-8。忽略溶液的体积变化]。
(6)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
-
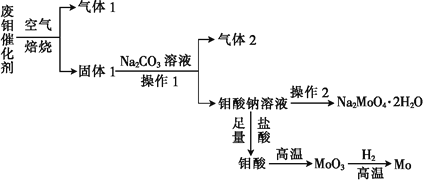
钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:
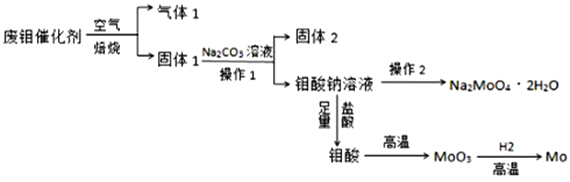
回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________(填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________;
(3)操作2为______________________________;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________;
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
-
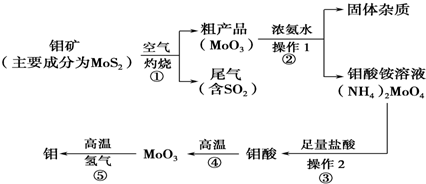
(11 分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
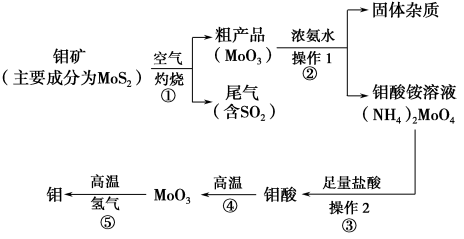
(1)反应①的尾气可以用NH3•H2O溶液吸收合成肥料,写出反应的离子方程式 .
(2)钼酸铵溶液中的主要阳离子的检验方法: .
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)写出反应①的化学方程式: 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,
2CO+2H2,
CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
-
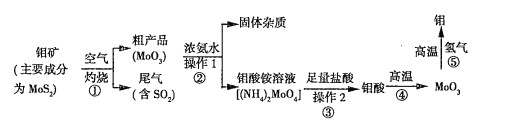
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
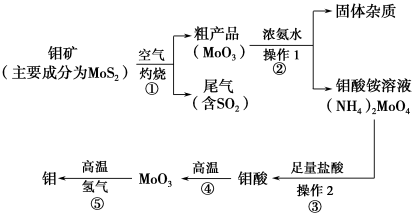
(1)写出反应①的化学方程式: 。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂 。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
-
(12分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的实验流程图:
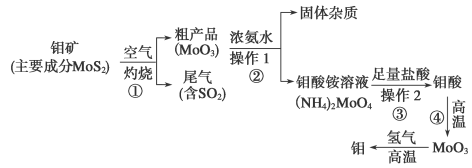
(1)钼酸铵溶液中阳离子的检验方法:________________________________________。
(2)写出反应①的化学方程式:______________________________________________。
(3)反应①的尾气可以用NH3·H2O溶液吸收用于合成肥料,写出反应的离子方程式
______________________________________________________________________。
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O ,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
①H2O2的作用是将溶液中的Cr3+转化为Cr2O ,写出此反应的离子方程式:______________。
,写出此反应的离子方程式:______________。
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | — | — | — |
| 完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
加入NaOH溶液使溶液呈碱性,Cr2O 转化为CrO
转化为CrO 。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
③写出上述过程中用SO2作还原剂进行还原的离子方程式______________________。
-
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊接性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
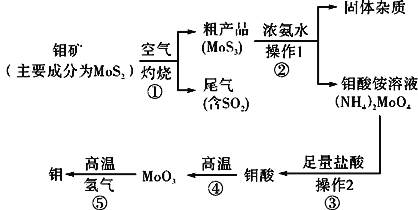
(1)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂:___。
(2)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有:___。
(3)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为___。
(4)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为___。
-
钼(Mo)是一种过渡金属元素,通常用作合金及不镑钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备 金属钼的主要流程图,已知钼酸难溶于水。
(1)写出反应①的化学方程式: 。
(2)写出反应②的化学方程式: 。
(3)反应①的尾气可以用碳酸钠溶液吸收。已知:根据表中提供的数据可知,在溶液中不能大量共存的微粒是______________;
A.HCO3-、HSO3- B. HCO3-、SO32- C.HCO3-、H2S03 D.HSO3- CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式: 。
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(5)工业上制备还原性气体CO和H2的反应原理为C02+CH4 2CO + 2H2,CH4 + H2
2CO + 2H2,CH4 + H2 CO + 3H2,含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原Mo03制钼,理论上能生产钼的质量为 g(小数点后保留1位,钼的相对原子质量为96)。
CO + 3H2,含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原Mo03制钼,理论上能生产钼的质量为 g(小数点后保留1位,钼的相对原子质量为96)。
-
钼是一种过渡金属元素,其单质通常用作合金及不锈钢的添加剂,这种金属可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的主要流程:
(1)用简单氧化物形式表示 的组成:____________________________。
的组成:____________________________。
(2)写出反应①的化学方程式:______________________。
(3)反应①的尾气可以再利用,写出两种利用该尾气制得的化学药品:______________________。
(4)工业上制备还原性气体的反应原理有: ,
, 。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体(
。将含甲烷体积分数为80%的a L(标准状况下)天然气与足量二氧化碳和水蒸气混合物在高温下反应,甲烷的转化率为90%,用产生的还原性气体( 和
和 )依据反应⑤冶炼钼,理论上生成钼的质量为___________(已知
)依据反应⑤冶炼钼,理论上生成钼的质量为___________(已知 的相对原子质量为96)
的相对原子质量为96)
-
钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
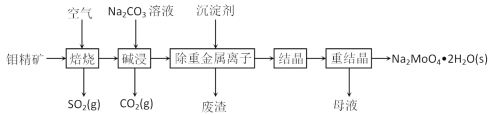
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
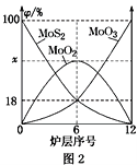
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕