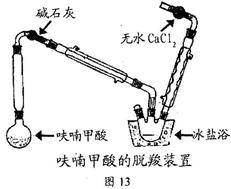
-
2016年我国将实施新的《环境空气质量标准》。下列措施有利于改善大气质量、保护环境的是
①出行尽量多开私家车,少乘坐公交车; ②推广洁净煤利用技术
③优化能源结构,提高能源利用效率; ④生活垃圾露天焚烧
A.②③ B.③④ C.①④ D.①②
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电予的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④、
难度: 中等查看答案及解析
-
最近俄罗斯科学家用铪和钨两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据182 72Hf(铪—182)和182 74W(钨—182)两种核素的含量比例得出的。下列有关铪—182和钨—182的关系说法正确的是
A.互为同位素 B.都属于镧系元素 C.中子数相等 D.原子质量几乎相同
难度: 中等查看答案及解析
-
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
难度: 中等查看答案及解析
-
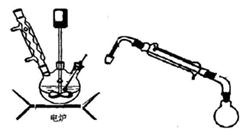
某同学如图所示装置进行实验,当滴入液体后出现气球体积缩小了,则使用的固体和液体试剂可能是( )

A.铜与浓硫酸 B.铁与浓硫酸
C.铝和氢氧化钠溶液 D.二氧化锰和浓盐酸
难度: 简单查看答案及解析
-
下列离子方程式表示正确的是
A.AgNO3溶液中加入Cu :Cu+Ag+=Cu2++Ag
B.NaHCO3溶液中加入CH3COOH:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
C.0.1mol FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 困难查看答案及解析
-
已知101kPa下有:H2(g)+1/2 O2(g)=H2O(g);△H=-241.8kJ/mol。则下列说法或表达中正确的是( )
A.H2的燃烧热为241.8kJ/mol
B.H2(g)+1/2O2(g)=H2O(l);△H<-241.8kJ/mol
C.2H2(g)+O2(g)=2H2O(g);△H>-241.8kJ/mol
D.1molH2与1/2molO2的总能量小于1molH2O(g)的总能量
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.25℃,pH=2的HCl溶液中含有H+的数目为0.01NA
B.1mol Na2O2固体中含有的阴阳离子总数为4 NA
C.1mol碳烯(:CH2)中含有的电子数8NA
D.5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA
难度: 困难查看答案及解析
-
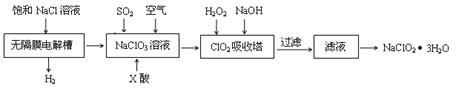
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。

下列有关说法不正确的是
A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
C.在过程③⑤中溴元素均被氧化
D.过程①中除去粗盐中的SO
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
难度: 中等查看答案及解析
-
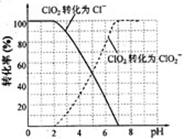
化学中常用图像直观的描述化学反应的进程或结果。下列图像描述正确的是:

A.根据图①可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH<0
B.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液的pH随加入酸体积的变化
C.根据图③(S表示溶解度),A点表示T1oC时甲为饱和溶液,乙溶液未饱和。
D.根据图④可判断可逆反应“A2(g)+3B2(g)
2AB3(g)”的ΔH>0
难度: 困难查看答案及解析
-
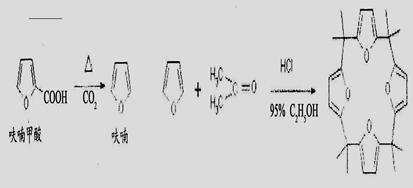
萜类物质中有许多都已被用于香料工业。常见的有如下几种结构(括号内表示④的结构简式):
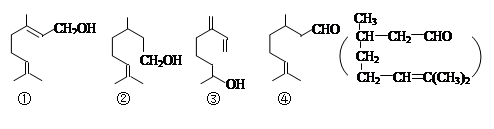
关于上述四种香料,下列说法正确的是
A.②和③均属于烯烃类 B.①和③互为同系物
C.④是②的氧化产物 D.③和④均能发生消去、酯化反应
难度: 简单查看答案及解析
-
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,
电池总反应式为:

则下列说法正确的是
A.放电时:负极板上发生了还原反应
B.放电时:正极反应是

C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是

难度: 简单查看答案及解析
-
在恒温恒容的密闭容器中,发生反应3A(g)+B(g)
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=12" n(B)时,可断定x=4
难度: 极难查看答案及解析
-
下列实验不能达到预期目的的是
代号 实 验 实验目的
A Cl2、Br2分别与H2反应 比较氯与溴的非金属性强弱
B 同温下测定相同浓度的Na2CO3,
和Na2SO4溶液的酸碱性 比较硫酸与碳酸的酸性强弱
C AlCl3、MgCl2溶液中通人过量氨气 比较镁与铝单质的还原性强弱
D 同温下用同一电路分别测定同浓度的
盐酸和某一元酸溶液导电能力 比较该一元酸与盐酸酸性的强弱
难度: 简单查看答案及解析
-
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
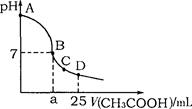
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
难度: 困难查看答案及解析